
| A、钠和水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、二氧化硅与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、金属铝溶于氢氧化钠溶液中:2Al+2OH-=2AlO2-+H2↑ |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、断开1个N≡N键的同时有6个N-H键生成 |
| B、混合气体的密度不变 |
| C、混合气体的平均相对分子质量不变 |
| D、N2、H2、NH3分子数之比1:3:2的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是化学能与电能相互转换的两套装置.对此两套装置进行的实验分析正确的是( )
如图是化学能与电能相互转换的两套装置.对此两套装置进行的实验分析正确的是( )| A、两装置中的铁电极均发生氧化反应 |
| B、图2装置能将电能转化为化学能 |
| C、两装置中石墨电极上产生的气体都是H2 |
| D、实验结束后,两套装置溶液的pH都将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、SO2(g)+
| ||
| B、2SO2(g)+O2(g)?2SO3(l);△H=-196.6KJ?mol-1 | ||
C、SO2(g)+
| ||
| D、2SO2(g)+O2(g)?2SO3(g);△H=+196.6KJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
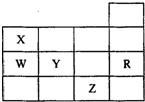 如图为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是( )| A、常温常压下,五种元素的单质中有两种是气态 |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物比X的氢化物稳定 |
| D、Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X能形成化学式为X(OH)2的碱 |
| B、X能形成化学式为NaXO2的含氧酸钠盐 |
| C、X原子的最外层电子数和核电荷数不可能为偶数 |
| D、X能与某些金属元素或非金属元素形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
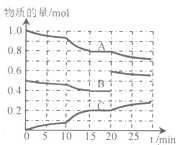 (Ⅰ)在一定条件下,发生反应:
(Ⅰ)在一定条件下,发生反应:| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com