��2013?����ģ�⣩��������Ҫ�Ļ�����Ʒ֮һ��
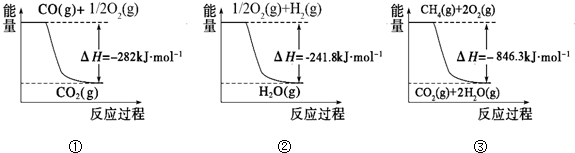
��1���ϳɰ��õ��������Լ���Ϊԭ���Ƶã��йػ�ѧ��Ӧ�������仯��ͼ��ʾ����Ӧ�٢ڢ�Ϊ
����
����
��Ӧ������ȡ����ȡ�����CH
4��g����H
2O��g����Ӧ����CO��g����H
2��g�����Ȼ�ѧ����ʽΪ
CH4��g��+H2O��g��=CO��g��+3H2 ��g����H=+161.1kJ?mol-1
CH4��g��+H2O��g��=CO��g��+3H2 ��g����H=+161.1kJ?mol-1
��
��2���ð�����ȡ����[CO��NH
2��
2]�ķ�ӦΪ��2NH
3��g��+CO
2��g��?CO��NH
2��
2��l��+H
2O��g����
��ij�¶��£����ݻ�Ϊ10L���ܱ�������ͨ��2mol NH
3��1molCO
2����Ӧ�ﵽƽ��ʱCO
2��ת����Ϊ50%���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=
�����¶���ƽ�ⳣ��K�ļ�����Ϊ
100 L2?mol-2
100 L2?mol-2
��
��Ϊ��һ�����CO
2��ƽ��ת���ʣ����д�ʩ���ܴﵽĿ����
AB
AB
A�����NH
3��Ũ�� B������ѹǿ
C����ʱת�����ɵ����� D��ʹ�ø���Ч�Ĵ�����




 ��У����ϵ�д�
��У����ϵ�д�
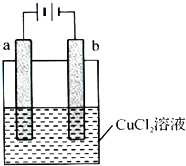 ��2013?����ģ�⣩ijС��Ϊ�о��绯ѧԭ�����������ͼװ�ã�������������ȷ���ǣ�������
��2013?����ģ�⣩ijС��Ϊ�о��绯ѧԭ�����������ͼװ�ã�������������ȷ���ǣ�������