

(1)步骤②中,用硝酸而不用HI的原因是____________________________________。
(2)有人认为①中碘单质制出了氯单质,说明碘的氧化性强于氯气,你认为是否正确?为什么?
(3)实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有_______________。
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为___________________________。
(5)参照下表碘酸钾的溶解度,步骤![]() 得到碘酸钾晶体,你建议的方法是___________。
得到碘酸钾晶体,你建议的方法是___________。
温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
KIO | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)HI具有还原性,能将已生成的碘酸氢钾还原
(2)不正确,碘在本反应中作还原剂,没有表现氧化性,无法比较。
(3)漏斗、烧杯、玻璃棒
(4)KH(IO3)2+KOH![]() 2KIO3+H2O
2KIO3+H2O
(5)蒸发浓缩、冷却结晶
解析:本题为无机化工流程题,但主要考查的是氧化还原反应、结晶方法、实验仪器等,只要考生细心,就很容易获得满分,属于容易题。(1)HI与HNO3的不同之处在于I-有较强的还原性,能与KH(IO3)2发生价态归中的氧化还原反应;(2)要证明I2的氧化性比Cl2强,应该是进行I2+2Cl-![]() Cl2+2I-的实验探究才行;(3)注意关键词“玻璃仪器”,不要多答了铁架台(带铁圈);(4)提取表中信息是关键:KIO3的溶解度随温度升高而增大,但增大幅度不是很大。所以,需要同时进行蒸发溶剂和冷却而促使其结晶。
Cl2+2I-的实验探究才行;(3)注意关键词“玻璃仪器”,不要多答了铁架台(带铁圈);(4)提取表中信息是关键:KIO3的溶解度随温度升高而增大,但增大幅度不是很大。所以,需要同时进行蒸发溶剂和冷却而促使其结晶。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2010-2011学年广东省高三临门一脚综合测试(理综)化学部分 题型:填空题
KIO3在酸性条件下是一种较强的氧化剂,在碱性介质中能被Cl2、次氯酸盐氧化为KIO4。KIO3在常温下稳定,加热至560℃开始分解。工业生产KIO3的流程如下:
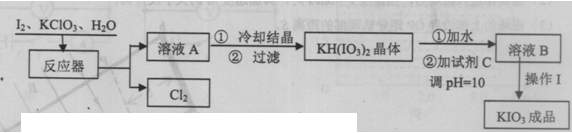
(1)写出反应器中生成KH(IO3)2的化学方程式:
6I2+11KClO3+3H2O= 。
当有1.2 mol电子转移的时候,生成KH(IO3)2的物质的量为 。
(2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
(3)调pH=10时,所加试剂C最好是 。
A.NaOH B.NH3·H2O C.KOH D.KCI
(4)从溶液B中得到碘酸钾固体,进行的操作I包括 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)碘酸钾在酸性条件下是一种强氮化剂,与氢碘酸、二氧化硫等还原性物质反应时被还原为单质碘。碘酸钾在常温下稳定,但加热至560℃开始分解。工业生产碘酸钾的流程如下图所示。①中的反应为:6I2+11KC1O3+3H2O=6KH(IO3)2+5KC1+3C12
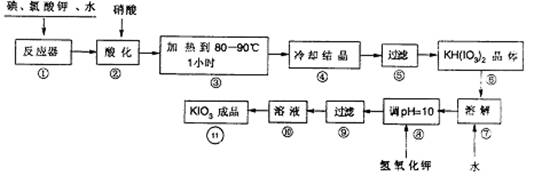
7-1.步骤②中,不能用HI的原因是:
7-2.有人认为①中由不碘单质制出了氯单质,说明碘单质的氧化性强于氯气,你认为是否正确?为什么?
7-3. 实验中涉及两次过滤,在实验室进行过滤时用到的玻璃仪器有:
7-4.步骤⑧用氢氧化钾调节溶液有pH,反应的化学方程式为:
7-5.碳酸钾的溶解度如下:
温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
KIO3g/1100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
步骤11得到碘酸钠晶体,你的建议方法是:
查看答案和解析>>
科目:高中化学 来源: 题型:
KIO3在酸性条件下是一种较强的氧化剂,在碱性介质中能被Cl2、次氯酸盐氧化为KIO4。KIO3在常温下稳定,加热至560℃开始分解。工业生产KIO3的流程如下:
(1)写出反应器中生成KH(IO3)2的化学方程式:
6I2+11KClO3+3H2O= 。
当有1.2 mol电子转移的时候,生成KH(IO3)2的物质的量为 。
(2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
(3)调pH=10时,所加试剂C最好是 。
A.NaOH B.NH3·H2O C.KOH D.KCI
(4)从溶液B中得到碘酸钾固体,进行的操作I包括 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
查看答案和解析>>
科目:高中化学 来源:2011届广东省华南师大附中高三临门一脚综合测试(理综)化学部分 题型:填空题
KIO3在酸性条件下是一种较强的氧化剂,在碱性介质中能被Cl2、次氯酸盐氧化为KIO4。KIO3在常温下稳定,加热至560℃开始分解。工业生产KIO3的流程如下:
(1)写出反应器中生成KH(IO3)2的化学方程式:
6I2+11KClO3+3H2O= 。
当有1.2 mol电子转移的时候,生成KH(IO3)2的物质的量为 。
( 2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
2)生产过程中,在反应器中加入反应物之后,还需加入硝酸酸化并保持微沸1小时,加硝酸的目的是 。微沸1小时的目的是 。
(3)调pH=10时,所加试剂C最好是 。
A.NaOH B.NH3·H2O C.KOH D.KCI
(4)从溶液B中得到碘酸钾固体,进行的操作I包括 。
A.蒸发浓缩 B.冷却结晶 C.蒸发结晶 D.过滤洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com