
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)两个热化学方程式的区别在于物质的聚集状态不同,固体→液体→气体的过程为吸热过程,反之为放热过程,以此解答该题;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;
(4)依据热化学方程式和盖斯定律计算求解;
解答 解:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,
则△H=-1452.8KJ/mol,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ;
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)a与b相比较,由于气体变成液体放热,则b反应放出的热量比a多,由于a,b都是负值,则a>b,
故答案为:>;
(3)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-391kJ•mol-1×6=-93kJ•mol-1=a kJ•mol-1,因此a=-93,
故答案为:-93;
(4)①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律②+③+①×2得到3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1,
故答案为:-246.4 kJ•mol-1
点评 本题考查反应热的计算,注意根据已知热化学方程式利用盖斯定律计算反应热的方法,答题时注意体会,题目难度中等.


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
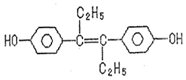
| A. | 可与NaOH和NaHCO3发生反应 | |
| B. | 可以用有机溶剂萃取 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有18个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.09 | 0.08 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
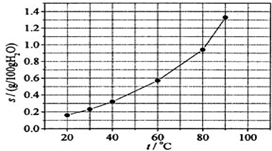
| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
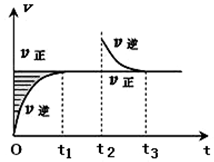 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | Z和W在该条件下至少有一个是为气态 | |
| B. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| C. | 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 | |
| D. | 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁的硬度小于铝 | B. | 镁的熔、沸点低于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔、沸点高于钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/L | B. | 0.03mol/L | C. | 0.3mol/L | D. | 0.04mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com