
| 研究目的 | 温度(T) 对反应的影响 | 压强(p)对平衡常数的影响 | 压强(p)对反应的影响(p2>p1) | 温度(T)对反应的影响(T1>T2) |
| 图示 | 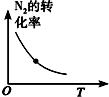 | 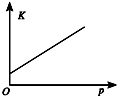 | 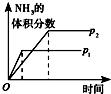 |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A、该反应为放热反应,升高温度,平衡逆向移动,氮气的转化率降低;
B、平衡常数只与温度有关,随温度变化而变化;
C、依据先拐先平压强大分析,P1>P2,反应是气体体积减小的反应,增大压强平衡正向进行,氨气体积分数增大;
D、依据先拐先平温度高分析,T1<T2,升高温度,反应速率加快,平衡向吸热的方向移动,故向逆反应方向移动,氨气的体积分数减小.
解答 解:A、该反应为放热反应,升高温度,平衡逆向移动,氮气的转化率降低,故A正确;
B、平衡常数只与温度有关,随温度变化而变化,故B错误;
C、依据先拐先平压强大分析,P1>P2,反应是气体体积减小的反应,增大压强平衡正向进行,氨气体积分数增大,故C错误;
D、依据先拐先平温度高分析,T1<T2,升高温度,反应速率加快,平衡向吸热的方向移动,故向逆反应方向移动,氨气的体积分数减小,故D错误.
故选A.
点评 本题考查了化学平衡图象分析判断,化学平衡的建立和影响平衡的因素分析判断是解题关键,注意图象中表示的反应速率的改变,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 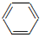 +HO-Na2$→_{60℃}^{浓硫酸}$ +HO-Na2$→_{60℃}^{浓硫酸}$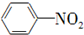 +H2O +H2O | |
| C. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | |
| D. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
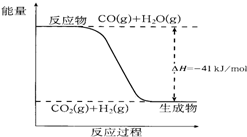 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
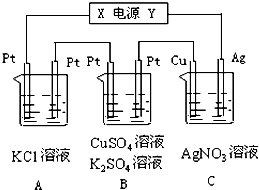 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数相同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
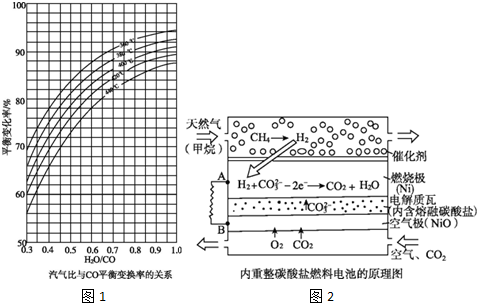
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
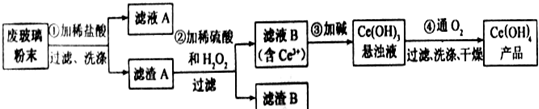
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com