
现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______________________。
(2)④、⑤、⑦、⑧四种溶液中NH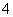 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH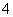 )
)
B.c(Na+)=0.1 mol/L
C.c(Na+)+c(NH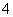 )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
解析:(1)①、②、③抑制水的电离,①中c(H+)=0.2 mol/L,②中c(H+)<0.1 mol/L,③中c(OH-)=0.1 mol/L,④促进水的电离,故四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①。
(2)NH4HSO4溶液中,H+抑制NH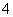 水解,CH3COONH4溶液中,CH3COO-促进NH
水解,CH3COONH4溶液中,CH3COO-促进NH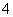 的水解,NH3·H2O是弱电解质,电离产生极少的NH
的水解,NH3·H2O是弱电解质,电离产生极少的NH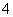 ,故四种溶液中NH
,故四种溶液中NH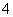 浓度由大到小的顺序为⑦④⑤⑧。
浓度由大到小的顺序为⑦④⑤⑧。
(3)NaOH溶液和NH4Cl溶液等浓度等体积混合:NaOH+NH4Cl===NaCl+NH3·H2O,c(Na+)=c(Cl-)=0.05 mol/L,c(OH-)=c(NH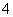 )+c(H+),A正确,B不正确。根据电荷守恒,C不正确。溶液显碱性c(OH-)>c(H+),D不正确。
)+c(H+),A正确,B不正确。根据电荷守恒,C不正确。溶液显碱性c(OH-)>c(H+),D不正确。
答案:(1)④②③① (2)⑦④⑤⑧ (3)A


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
(1) )已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
 H2(g) + O2(g)
H2(g) + O2(g)  H2O(g) ΔH=-285.8 kJ•mol-1
H2O(g) ΔH=-285.8 kJ•mol-1
CO(g) + O2(g)  CO2(g) ΔH=-283.0 kJ•mol-1
CO2(g) ΔH=-283.0 kJ•mol-1
则固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是
(2) 我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下, 2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
(4)由甲烷、氧气和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。回答下列问题:

(1)写出各物质的化学式:A________、B________、C________、D________、E________。
(2)写出B→C、D→E反应的离子方程式:
B→C:________________________________________________________________________;
D→E:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下除杂方法(括号内为少量杂质)中,错误的是( )
A.Fe(OH)3胶体(FeCl3溶液):蒸馏水,渗析
B.KCl(I2)固体:加热,升华
C.NaCl(KNO3):蒸发结晶
D.CO2(SO2):通过饱和NaHCO3溶液、浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列水解的离子方程式正确的是( )
A.HCO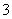 +H2O
+H2O CO2↑+OH-
CO2↑+OH-
B.S2-+2H2O H2S+2OH-
H2S+2OH-
C.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.CO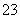 +H2O
+H2O HCO
HCO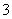 +OH-
+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
A.c(HCO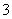 )>c(ClO-)>c(OH
)>c(ClO-)>c(OH -)
-)
B.c(ClO-)>c(HCO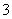 )>c(H+)
)>c(H+)
C.c(HClO)+c(ClO-)=c(HCO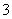 )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO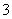 )+c(ClO-)+c(OH-)
)+c(ClO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 | HA的物质的量浓度(mol/L) | NaOH的物质的量浓度(mol/ L) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
________________________________________________________________________。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________________________________________________________________________。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=________ mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB- HB-H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸
化剂,在医学上也有广泛用途。下列关于物质X的说法正确的是( )
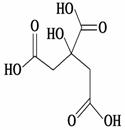 A.X的分子式为C6H7O7
A.X的分子式为C6H7O7
B.1 mol物质X最多可以和3 mol氢气发生加成反应
C.X分子内所有原子均在同一平面内
D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应
得到的气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s)  Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱溶液来调整溶液的pH,使溶液的pH大于
Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol/L的CuSO4溶液中加入碱溶液来调整溶液的pH,使溶液的pH大于
( )
A.2 B.3
C.4 D.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com