
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
18
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用生产甲醇的废催化剂(主要成分为ZnO和CuO,还含有少量有机杂质等)制散CuCl和ZnO的工艺流程如下:
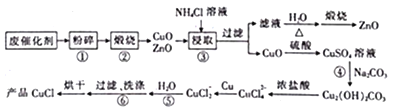
已知用NH4Cl溶液设取时.发生的主要反应如下,
ZnO(s)+2NH4Cl(aq)![]() Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
CuO(s)+2NH4Cl(aq)![]() Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
回答下列同题:
(1)预处理时,废催化剂需进行“粉碎”的主要目的是________;步骤②中“煅烧”的目的是______________。
(2)步骤④发生反应的离子方程式为______________________________。
(3)步骤⑤加H2O稀释的目的是____________________________________________。
(4)步骤⑥过滤、洗涤时,若要检验是否洗涤干净,其实验操作是_____________________。
(5)准确称取mg产品CuCl,将其溶于稍过量的FeCl3溶液中,充分溶解后、加入适量的稀硫酸,用cmol·L-1的K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液的体积为VmL。已知滴定时Cr2O72-被还原为Cr3+,则滴定过程中发生反应的离子方程式为______________________;该反应中氧化剂与还原剂的物质的量之比为________;该产品中CuCl的质量分数为________(用含c、m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分利用碳的氧化物合成化工原料,既可以减少环境污染和温室效应,又能变废为宝。
Ⅰ.CO2的综合利用是解决温室效应及能源问题的有效途径。
(1)O2和H2在催化剂存在下可发生反应生成CH3OH。已知CH3OH、H2的燃烧热分别为△H1=-akJ·mol-1、△H2=-bkJ·mol-1,且1mol水蒸气转化为液态水时放出ckJ的热量。
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
CH3OH(g)+H2O(g)△H=___________kJ·mol-1。
(2)对于CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。
CH3OH(g)+H2O(g).控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇产率的影响如图所示。由图可知获取CH3OH最适宜的温度是___________,下列有利于提高CO2转化为CH3OH的平衡转化率的措施是___________。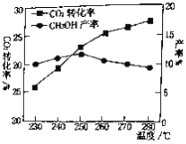
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
Ⅱ.CO是合成尿素、甲酸的原料。
(3)合成尿素的反应:2NH3(g)+CO(g)![]() CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
CO(NH2)2(g)+H2(g)△H=-81.0kJ·mol-1。
①T℃时,在体积为2L的恒容密闭容器中,将2molNH3和1molCO混合发生反应,5min时,NH3的转化率为80%。则0~5min内的平均反应速率为v(CO)=___________。
②已知:
温度/K | 398 | 498 | … |
平衡常数/K | 126.5 | K1 | … |
则:K1___________126.5(填“>”或“<”);其判断理由是___________。
(4)通过人工光合作用可将CO转化成HCOOH。
①已知常温下,浓度均为0.1mol·L-1的HCOOH和HCOONa混合溶液pH=3.7,则HCOOH的电离常数Ka的值为___________ (已知lg2=0.3)。
②用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。Co3+氧化HCOOH的离子方程式为___________;忽略体积变化,电解前后Co2+的浓度将___________ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有1个电子的元素一定是金属元素
B.最外层只有2个电子的元素一定是金属元素
C.原子核外各层电子数相等的元素一定是金属元素
D.原子最外层电子数不能超过8个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生下列反应,其中属于盐类水解反应的是( )
A. Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. HCO3-+ H2O![]() H3O++ CO32-
H3O++ CO32-
C. H2S![]() H++HS-
H++HS-
D. NH4++2H2O![]() NH3·H2O + H3O+
NH3·H2O + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。回答下列问题:
(1)两个常见的固氮反应为:
N2(g)+O2(g)![]() 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)
N2(g)+3H2(g)![]() 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)
①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=_________________。
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
温度/K | 298 | 473 | 673 |
Kp | 62(KPa)-2 | 6.2×10-5(KPa)-2 | 6.0×10-8(KPa)-2 |
则反应(Ⅱ) 的ΔH________0(填“>”、“<”或“=”)
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g)![]() [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)
ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为________________________。
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -907kJmol-1
4NO(g)+6H2O(g) △H= -907kJmol-1
②4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H= -1269kJmol-1
2N2(g)+6H2O(g) △H= -1269kJmol-1
其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是___________________;
T℃时N2和O2反应生成NO的热化学方程式为________________________________。
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为____mg·L-1;下列铵盐不适合用甲醛法测定含氮量的是____________(填标号)。
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。

![]()
下列说法不正确的是
A. 5-FAM转变为5-CFDA属于取代反应
B. 5-FAM的分子式为C21H12O7
C. 5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,消耗NaOH 物质的量相同
D. 实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com