
(本题共14分)以下是由甲苯合成乙酰水杨酸和酚酞的合成路线。
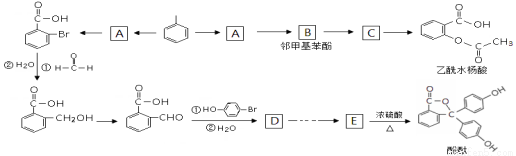
1.写出“甲苯→A”的化学方程式___________________________________________。
2.写出C的结构简式___________,E分子中的含氧官能团名称为__________________;
3.上述涉及反应中,“E→酚酞”发生的反应类型是______________。
4.写出符合下列条件的乙酰水杨酸的一种同分异构体的结构简式_________________。
(1)遇FeCl3溶液显紫色, (2)能与碳酸氢钠反应
(3)苯环上只有2个取代基的, (4)能使溴的CCl4溶液褪色。
5.写出乙酰水杨酸和NaOH溶液完全反应的化学方程式:
____________________________________________________________________。
6.由D合成E有多步,请设计出D→E的合成路线(有机物均用结构简式表示)。
(合成路线常用的表示方式为:D ……
…… E)
E)
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
向100 mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示。下列分析错误的是.
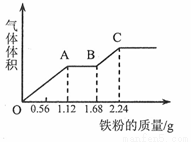
A.原混合酸溶液的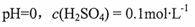
B.OA段的反应为:
C.AB段的反应为: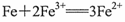
D.BC段气体产物为氢气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:选择题
在25 ℃时,将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是
A.该溶液的pH小于7
B.c(CH3COOH)+c(CH3COO-)=0.20 mol·L-1
C.c(CH3COO-)+c(OH-)=0.10 mol·L-1
D.c(CH3COOH)<c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市第二次诊断性测试化学试卷(解析版) 题型:简答题
(14分)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷下图为以天然气为原料制备化工产品的工艺流程
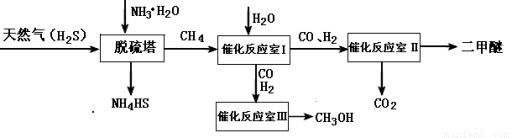
(1)CH4的VSEPR模型为
(2)一定条件下向NH4HS溶液中通入空气,得到单质硫并能使氨水再生,写出氨水再生时的化学反应方程式
(3)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g);ΔH=-90.8 kJ·mol1
CH3OH(g);ΔH=-90.8 kJ·mol1
②2CH3OH(g)  CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol1
CH3OCH3(g)+H2O(g);ΔH=-23.5kJ·mol1
③CO(g)+H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol1
则催化反应Ⅱ室的热化学方程式为
(4)在一定条件下,反应室Ⅲ(容积为VL)中充入amolCO与2amolH2 ,在催化剂作用下反应生成甲醇:
CO(g) +2H2(g) CH3OH(g),CO的平衡转化率与温度压强的关系如图所示,则:①P1 P2(填“<”“=”或“>”)。
CH3OH(g),CO的平衡转化率与温度压强的关系如图所示,则:①P1 P2(填“<”“=”或“>”)。
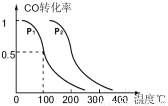
②在其它条件不变的情况下,反应室Ⅲ再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”“减小”或“不变”)。
③在P1压强下,100℃时,反应:CH3OH(g) CO(g)+2H2(g)的平衡常数为 (用含aV的代数式表示)
CO(g)+2H2(g)的平衡常数为 (用含aV的代数式表示)
(5)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4铜电极表面的电极反应式

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市第二次诊断性测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1 KHCO3溶液中:Ca2+ Al3+ Cl—C2O42-
B.水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+Ba2+Cl-I-
C.1.0 mol·L-1 KI溶液中:H+Fe3+SCN-SO42-
D.pH=13的溶液中:NH4+Na+NO3-SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:填空题
(本题共12分)TiCl4是一种重要的化工原料,其工业生产过程如下:
2FeTiO3(s) + 7Cl2(g) + 6C (s)  2TiCl4 (g) + 2FeCl3(g) + 6CO(g) – Q (Q>0)
2TiCl4 (g) + 2FeCl3(g) + 6CO(g) – Q (Q>0)
回答下列问题:
1.该反应达到平衡后,若使正反应速率增大可采取的方法有_________。(选填编号)
a.加压 b.加入碳 c.升温 d.及时移走CO
2.若上述反应在固定体积的密闭容器中发生,一定能说明反应已达平衡的是_______。(选填编号)
a. 反应物不再转化为生成物
b. 炉内FeTiO3与TiCl4 的质量比保持不变
c. 反应的热效应不再改变
d. 单位时间内,n(FeTiO3)消耗:n(FeCl3)生成=1:1
3.上述反应中所有非金属元素原子的半径从大到小的顺序为_____________;其中不属于同周期又不属于相邻族的两元素形成_____分子(填“极性”或“非极性”),通过比较____________可以判断这两种元素的非金属性。
4.上述反应中,非金属性最弱的元素原子的电子共占据_______个原子轨道,最外层电子排布式为____________。它形成的固态单质中只含一种强烈的相互作用力,则该单质属于______晶体。
5.为方便获得氯气,工业制TiCl4厂可以和氯碱厂进行联合生产。CO可合成甲醇,若不考虑损失,上述联合生产在充分利用各种副产品的前提下,合成192 kg甲醇,至少需补充H2 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
反应2NO2(g) N2O4(g) + 57 kJ,若保持气体总质量不变。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2O4(g) + 57 kJ,若保持气体总质量不变。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
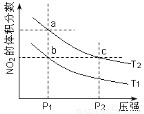
A.a、c两点气体的颜色:a浅,c深
B.a、c两点气体的平均相对分子质量:a>c
C.b、c两点的平衡常数:Kb=Kc
D.状态a通过升高温度可变成状态b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
[化学—选修3:物质结构与性质](15分)
(1)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌元素在周期表中的位置: 周期, 族, 区。
②NH3分子中氮原子的杂化轨道类型为 ,基态氮原子的核外电子排布式是 ;
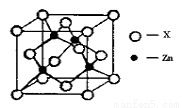
③下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为140-145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
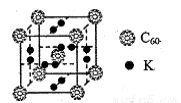
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则 Si60分子中的数目为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:填空题
(8分)下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
族 周期 | ⅠA | 0 | |||||||
1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ⑤ | Ne | |||||||
3 | ① | ② | ③ | ④ | ⑥ |
(1)元素④的符号是 ;
(2)⑤和⑥两种元素原子半径的大小关系:⑤ ⑥(填“>”或“<”);
(3)①和②两种元素金属性强弱关系:① ②(填“>”或“<”);
(4)①的最高价氧化物的水化物与元素③的单质反应的化学方程式为: _ ________ _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com