
下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.反应N2(g)+3H2(g) 2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
2NH3(g)△H<0平衡时,其他条件不变,升高温度,再次达到平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g) TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:填空题
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:_______________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_______________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是___。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是

A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO- , 还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5∶2
D.若生成2.24 L N2(标准状况),则转移电子0.5 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:简答题
【化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
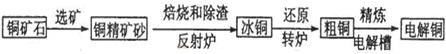
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。

在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列涉及有机物的说法正确的是
A.纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应
B.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
C.苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴
D.高温或日常用的消毒剂可使禽流感病毒蛋白质变性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
工业上常用铁质容器盛装冷浓硫酸,为研究铁质材料与热浓硫酸的反应,某学校学习小组进行以下探究实验:
[一](1)将已除去表面氧化物的铁钉(碳素钢)放入冷的热的浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 ;
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用
(选填序号)
a.KSCN溶液和氯水 .b铁.粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应SO2+Br2+2H2O═2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g由于此推知气体Y中SO2的体积分数为 ;
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体,为此设计了下列探究实验装置(图中夹持仪器省略)
(3)装置B中试剂的作用是 ;
(4)认为气体Y中还含有Q的理由是 ;(用化学方程式表示)
(5)为确认Q的存在,需在装置中添加M于 (选填序号)
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验的现象应是 ;
(7)若要测定限定体积气体Y中H2含量(标准状况下约有28ml H2),除用测量H2体积方法外,否选用质量称量方法?做出判断并说明理由 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下表中关于离子方程式评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | 醋酸钠溶于水:CH3COO-+H2O=== CH3COOH+OH- | 正确 |
B | 在氢氧化钠溶液中滴加少量氯化铝: Al3++3OH-===Al(OH)3↓ | 错误,Al(OH)3能溶于氢氧化钠 |
C | 铁加入到过量的稀硝酸溶液中:3Fe + 8H+ +2 | 正确 |
D | 在硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀的物质的量最多:3Ba2++6OH-+2Al3++3 | 错误,Al3+与OH-的化学计量数之比为1∶3 |
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
已知某反应aA(g)+bB(g)?==?cC(g)的各物质浓度数据如下:
| A | B | C |
起始浓度(mol·L-1) | 3.0 | 1.0 | 0 |
2 s末浓度(mol·L-1) | 1.8 | 0.6 | 0.8 |
据此可推算出a∶b∶c是( )
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com