
(12分)Ⅰ.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______ ,直至滴定终点。判断到达终点的现象是___________ 。
(3)滴定前平视KOH液面,刻度为amL,滴定后俯视液面刻度为bmL,则(b-a)mL比实际消耗KOH溶液体积 (填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际 填“大”或“小”)。
(4)若酸式滴定管没有用盐酸润洗,对测定结果有何影响____________(填“偏大”、“偏小”或“无影响”,其他操作均正确)。
(1)BDCEAF
(2)锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(3)少,小 (4)偏小
【解析】
试题分析:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,故答案为:BDCEAF;(2)实验中眼睛注视锥形瓶中溶液的颜色变化;判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。(3)滴定前平视KOH液面,刻度为amL,滴定后俯视液面,读数读小了,刻度为bmL,则(b-a)mL比实际消耗KOH溶液体积少。根据(b-a)mL计算得到的待测浓度,比实际偏小;(4)若酸式滴定管没有用盐酸润洗,则盐酸的浓度降低,导致消耗NaOH少,测定结果偏小。
考点:考查酸碱中和滴定。


科目:高中化学 来源:2014-2015学年福建省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列关于新制氯水及久置氯水的说法,不正确的是
A.新制的氯水呈黄绿色,久置的氯水无色
B.新制的氯水漂白作用强,而久置的氯水漂白作用很弱
C.新制的氯水所含成分的种类多,而久置的氯水所含成分的种类较少
D.新制的氯水中无氯离子,而久置的氯水中则含氯离子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一12月月考化学试卷(解析版) 题型:填空题
(8分)下图表示的是向Na2CO3溶液中滴入稀盐酸(单位为ml)时产生CO2的过程。
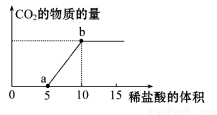
(1)写出a点以前发生反应的离子方程式:
(2)写出a到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含84.8g Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入的稀盐酸中的HCl的物质的量为 mol(保留小数点后两位数字)。
(4)已知HCO3-+OH-=== CO32-+H2O ,若某溶液中含1 mol NaHCO3,滴入一定量的稀NaOH,恰好使溶液中Na+ 和HCO3-的物质的量之比为2:1,则滴入的NaOH的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一12月月考化学试卷(解析版) 题型:选择题
下列状态的物质,既能导电又属于电解质的是
A.K 2SO4晶体 B.NaCl溶液 C.液态HCl D.熔融的KOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一12月月考化学试卷(解析版) 题型:选择题
下列各组中的两种物质作用时,反应条件或反应物的用量比改变,生成的化合物会改变的是
A.铁与氯气 B.氢氧化钠与二氧化碳
C.氧化钠与二氧化碳 D.过氧化钠与水反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定正确的是
A.若c(OH-)>c(H+),a=b B.若c(K+)>c(CH3COO-),a>b
C.若c(OH-)=c(H+),a>b D.若c(K+)<c(CH3COO-),a<b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者大于后者
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D.室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第三次月考化学试卷(解析版) 题型:填空题
(16分)海水中含有非常丰富的化学资,从海水中可提取多种化工原料。下图是某工厂对海水资综合利用的示意图。
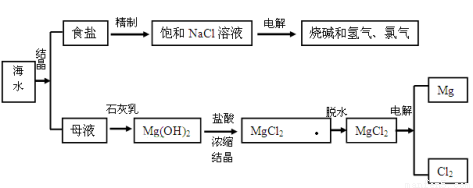
试回答下列问题:
(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,方法是将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液,合理的操作顺序是 ①③(填序号)。
(3)写出电解饱和食盐水的化学方程式 ,当转移0.2mol电子时,阴阳两极生成的气体体积之和是 (标准状况下)。
(4)以海边贝壳为原料可以制取石灰乳,贝壳的主要化学成分为 (写化学式)。
(5)目前,世界上生产的镁有60%自海水,由“母液”制“镁”的过程中,发生了 个复分解反应(填数目)。
(6)电解氯化镁所得的氯气,除用于生产盐酸外,还可以用于制取漂白粉,漂白粉的有效成份
是 (写化学式)。
(7)溴主要以Br-形式存在于海水中,提取食盐后剩下的母液(也叫卤水)中,Br-的浓度较大,工业上 制备的Br2的操作步骤为:一定条件下,将Cl2通入卤水中,生成Br2,利用热空气将Br2吹出,Br2可用热空气吹出,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省等四校高一上学期期中联考化学试卷(解析版) 题型:填空题
(8分)选择下列一种方法分离物质,将分离方法的序号填在横线上。
A.萃取分液
B.升华
C.结晶
D.分液
E.蒸馏
F.过滤
(1)从溴水中提取溴______________
(2)从含有少量氯化钠的硝酸钾混合液中获得硝酸钾___________
(3)分离水和汽油的混合物___________
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体___ ___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com