
【题目】一定质量铜和适量的浓硝酸反应,随着反应的进行,所生成的气体颜色逐渐变浅,当铜反应完毕后,共收集到11.2L由NO和NO2组成的混合气体(标准状况),将该气体与0.325molO2混合溶于水,恰好无气体剩余。则反应中消耗硝酸的物质的量为( )
A.1.2molB.1.1molC.1.8molD.1.6mol
【答案】C
【解析】
根据二氧化氮、一氧化氮和氧气反应的原理方程式:4NO+3O2+2H2O=4HNO3,4NO2+O2+2H2O=4HNO3,此时得到的硝酸的量即为气体的物质的量,根据得失电子守恒计算金属铜的物质的量,进而计算显示酸性的硝酸的物质的量,消耗的硝酸的物质的量=显示酸性的硝酸的物质的量+做氧化剂的硝酸的物质的量,据此分析解答。
整个反应过程,金属铜失去电子,氧气得到电子,根据得失电子守恒,设金属铜的物质的量是n,则2n=0.325mol×2×(2-0),解得n=0.65mol,所以显示酸性的硝酸在硝酸铜中,其物质的量是0.65mol×2=1.3mol,做氧化剂的硝酸的物质的量即为11.2L气体(标况)的物质的量![]() =0.5mol,所以反应中消耗硝酸的物质的量是1.3mol+0.5mol=1.8mol,故选C。
=0.5mol,所以反应中消耗硝酸的物质的量是1.3mol+0.5mol=1.8mol,故选C。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应或离子反应方程式正确的是( )
A.苯与溴水反应:![]() +Br2
+Br2![]() +HBr
+HBr
B.1一氯丙烷中加入氢氧化钠的水溶液并加热:CH3CH2CH2Cl+NaOH![]() CH3CH=CH2↑+NaCl+H2O
CH3CH=CH2↑+NaCl+H2O
C.苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
D.实验室制取乙炔的反应:CaC2+2H2O→Ca(OH)2+CH≡CH↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)过程中的能量变化示意图,已知E1=xkJmol﹣1、E2=ykJmol﹣1, 下列有关说法中正确的是( )
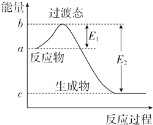
A.反应的活化能等于ykJmol﹣1
B.若对反应体系加热,△H不变
C.若在反应体系中加入催化剂,E1不变
D.1 molSO2Cl2(g)和1molSCl2(l)反应生成SOCl2(g)的△H=(x﹣y)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况____________。
(2)浓盐酸在该反应中表现了____________(选填“氧化性”、“还原性”或“酸性”)。
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有______mol HCl被氧化,产生的Cl2在标准状况下的体积为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),于2019年5月2日正式生效。设NA是阿伏加德罗常数的值,下列说法正确的是
A.40g正丁烷和18 g异丁烷的混合物中共价键数目为13NA
B.常温常压下,124 g P4中所含P—P键数目为4NA
C.电解精炼铜时,阳极质量减小3.2g时,转移的电子数为0.1NA
D.0.1mol FeCl3完全水解转化为氢氧化铁胶体,生成胶粒数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是____________________。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:______________________。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是____;
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=___mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是_________________。
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
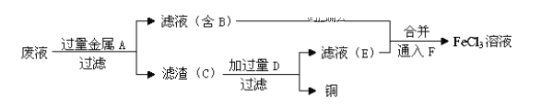
①滤渣C的化学式为___________。
②加过量D发生反应的离子方程式为_________________________。
③通入F发生反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com