
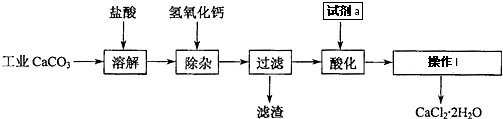
| 25 |
| 250 |
| 5×10-3mol×147g/mol |
| 0.7500g |


科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、CrO3 |
| C、Cr2(SO4)3 |
| D、C2H50H |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- | ||
B、常温下,
| ||
| C、0.1 mol/L的NaOH溶液中:K+、AlO2-、SO42-、CO32- | ||
| D、在PH=7的溶液中:Fe3+、Na+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④⑤ |
| C、①②⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.112L |
| B、1.12L |
| C、0.224L |
| D、2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 min末时,A和B的浓度之比为5:3 |
| B、x=1 |
| C、2 min末时,B的浓度为1.5 mol?L-1 |
| D、2 min末时,A的消耗浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,10.6gNa2C03含有的Na+数为0.1NA |
| C、通常状况下,NA个C02分子占有的体积大于22.4L |
| D、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
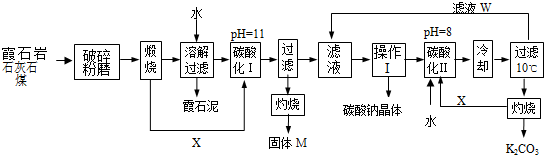

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com