
(12分)
(1)鉴别KCl溶液和K2CO3的试剂是 ;离子方程式为
(2)除去混入FeCl3溶液中少量FeCl2杂质的试剂是 ,离子方程式为 .
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
(4)除去混入MgO少量Al2O3杂质的试剂是————————,离子方程式为——————————。
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
(12分)
(1)鉴别KCl溶液和K2CO3的试剂是 ;离子方程式为
(2)除去混入FeCl3溶液中少量FeCl2杂质的试剂是 ,离子方程式为 .
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
(4)除去混入MgO少量Al2O3杂质的试剂是————————,离子方程式为——————————。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省苏州五中高二第二学期期中考试化学试卷(带解析) 题型:填空题
(12分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 _________ ,K值大小与温度的关系是:温度升高,K值_____________ 。(填一定增大、一定减小、或可能增大也可能减小)。
(2) 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)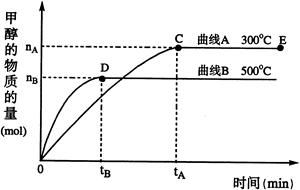
根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
③据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省南昌二中高一第二次月考化学试卷 题型:填空题
(12分)
(1)鉴别KCl溶液和K2CO3的试剂是 ;离子方程式为
(2)除去混入FeCl3溶液中少量FeCl2杂质的试剂是 ,离子方程式为 .
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
(4)除去混入MgO少量Al2O3杂质的试剂是————————,离子方程式为——————————。
查看答案和解析>>
科目:高中化学 来源:2014届陕西省高一下学期期末考试化学试卷(解析版) 题型:填空题
(12分)(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):
①_____,②_____。从能量转换的角度看,过程Ⅱ应是____能转化为_____能。

(2)图中的燃料电池也可以用A和氧气为原料。已知A分子是由碳和氢两元素的原子构成,并且8.00 g A中含有3.01×1023个分子。实验测得在298 K时,1 mol该气体完全燃烧生成液态水和二氧化碳,放出890 kJ的热量。
①写出该气体的化学式:______。
②写出1 mol该气体燃烧时的热化学反应方程式:_____________。
③已知1 mol液态的水变成气态水时需要吸收44 kJ的热量,则1 mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为________kJ。
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极反应为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com