
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 在101Kpa时,2g H2完全燃烧生成液态水,放出285.8 KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-53.7 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7 kJ |
分析 A.生成物相同,反应物中气态比固体能量高;
B.吸热反应的焓变为正;
C.燃烧反应为放热反应,焓变为负,且物质的量与热量成正比;
D.生成1mol水的中和热为53.7kJ,且浓硫酸稀释放热.
解答 解:A.生成物相同,反应物中气态比固体能量高,则燃烧反应中前者放出热量多,故A错误;
B.吸热反应的焓变为正,则△H>0表示吸热反应,△H<0表示放热反应,故B错误;
C.燃烧反应为放热反应,焓变为负,由2g H2完全燃烧生成液态水,放出285.8 KJ热量,可知氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-285.8 kJ•mol-1,故C错误;
D.由H+(aq)+OHˉ(aq)=H2O(l)△H=-53.7 kJ•mol-1,且浓硫酸稀释放热,可知将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7 kJ,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、燃烧热与中和热为解答的关键,侧重分析与应用能力的考查,注意物质的量、状态与能量的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
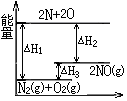
| A. | △H3>0 | B. | △H2为该反应的反应热 | ||
| C. | 反应N2(g)+O2(g)═2NO(g)为放热反应 | D. | △H3=△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融氯化钠可制金属钠 | |
| B. | 钠与氧气反应的产物与反应条件无关 | |
| C. | ClO2可用于自来水的消毒 | |
| D. | “氯碱工业”是指电解食盐水制取氯气等产品的工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
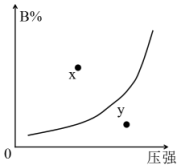 在一定温度下,反应mA(s)+nB(g)?pC(g)△H<0,B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
在一定温度下,反应mA(s)+nB(g)?pC(g)△H<0,B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | x点表示该反应的正反应速率小于逆反应速率 | |
| C. | n<p | |
| D. | x点比y点时的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “油脂的氢化”称为皂化反应 | |
| B. | 以乙烯为原料可制取乙酸乙酯 | |
| C. | 苯酚溶液加入FeCl3溶液呈现红色 | |
| D. | 利用甘油与硝酸反应可制得TNT炸药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com