
| A. | Mg2+、Al3+、F-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ne | D. | Mg2+、Na+、Cl-、S2- |
分析 A.四种粒子的核外电子总数都是10,核外电子排布相同;
B.Na+、F-的核外电子总数为10,S2-、Ar的核外电子总数为18;
C.K+、Ca2+、S2-,的核外电子总数为18,Ne核外电子总数为10;
D.Mg2+、Na+核外电子总数为10,Cl-、S2-的核外电子总数为18.
解答 解:A.Mg2+、Al3+、F-、Ne的核外电子总数都是10,核外电子排布都是2、8,相满足条件,故A正确;
B.Na+、F-的核外电子总数为10,核外电子排布,是2、8,S2-、Ar的核外电子总数为18,核外电子排布不完全相同,故B错误;
C.K+、Ca2+、S2-,的核外电子总数为18,核外电子排布是2、8、8,Ne核外电子总数为10,核外电子排布,是2、8,故C错误;
D.Mg2+、Na+核外电子总数为10,核外电子排布,是2、8;Cl-、S2-的核外电子总数为18,核外电子排布是2、8、8,故D错误;
故选A.
点评 本题考查了粒子的结构及核外电子排布,题目难度中等,明确常见粒子结构与核外电子排布规律为解答关键,试题侧重基础知识的考查,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 当x=2时,每生成lmolN2,转移电子数为4mol | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 等物质的量N2和C02中,共用电子对的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2NH4HCO3$\stackrel{△}{→}$2NH3↑+H2O+CO2↑ | ||
| C. | 4HCl+O2$\stackrel{△}{→}$2H2O+2Cl2 | D. | NaHCO3+NaHSO4═Na2SO4+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
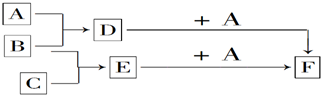
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
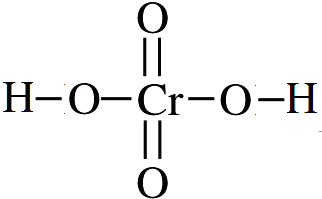 .
.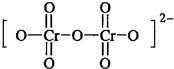
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
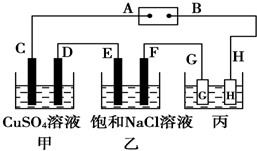 如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com