
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ | |
| C. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-═Al2S3↓ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: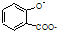 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
分析 A.碳酸氢根离子不能拆分;
B.强碱溶液中不能生成氢离子;
C.相互促进水解生成氢氧化铝和硫化氢;
D.酚钠转化为苯酚,同时生成碳酸氢钠.
解答 解:A.NaHCO3溶液和盐酸的离子反应为HCO3-+H+═H2O+CO2↑,故A错误;
B.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O,故B错误;
C.向硫化钠溶液中滴入氯化铝溶液的离子反应为6H2O+2Al3++3S2-═2Al(OH)3↓+3H2S↑,故C错误;
D. 溶液通入少量CO2的离子反应为
溶液通入少量CO2的离子反应为 +CO2+H2O→
+CO2+H2O→ +HCO3-,故D正确;
+HCO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
2SO2+O2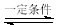 2SO3 是工业上制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3 是工业上制造硫酸的重要反应。下列关于该反应的说法正确的是
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率 
D.一定条件下达到反应限度时SO2全部转化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 | |
| C. | 25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大 | |
| D. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫 | |
| B. | 达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 | |
| D. | 在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
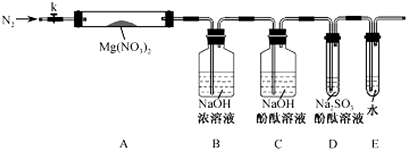
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
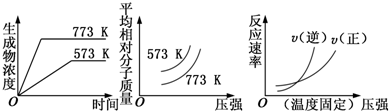
| A. | N2(g)+3H2(g)═2NH3(g)△H<0 | B. | 2SO3(g)?═?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?═?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 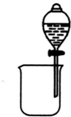 分离碘酒中的碘和酒精 | B. | 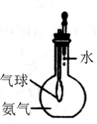 验证氨气易溶于水 | ||
| C. | 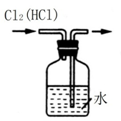 除去Cl2中的HCl杂质 | D. | 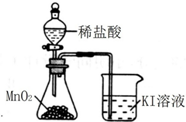 比较MnO2、Cl2、I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 | |
| B. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| C. | 利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 | |
| D. | 若要测定所得硫酸铜晶体中结晶水的数目,在实验中要用到坩埚和坩埚钳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com