

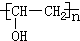 ;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;
;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;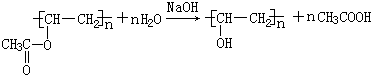 .
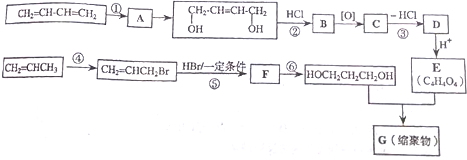
. 分析 B的分子式为C2H4O,不饱和度=$\frac{2×2+2-4}{2}$=1,分子中含有双键,B的核磁共振氢谱中有两个峰,峰面积之比为3:1,则其分子中含有1个甲基,所以B的结构简式为CH3CHO;B进一步氧化成C,C能够与A反应生成CH3COOCH2=CH2,则C为CH3COOH、A为CH2=CH2;CH3COOCH2=CH2通过反应Ⅱ生成D、D与氢氧化钠溶液反应生成聚乙烯醇,再结合不饱和碳原子与羟基直接相连不稳定可知D的结构简式为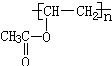 ,聚乙烯醇结构简式为
,聚乙烯醇结构简式为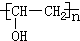 ,据此分析解答.
,据此分析解答.
解答 解:B的分子式为C2H4O,不饱和度=$\frac{2×2+2-4}{2}$=1,分子中含有双键,B的核磁共振氢谱中有两个峰,峰面积之比为3:1,则其分子中含有1个甲基,所以B的结构简式为CH3CHO;B进一步氧化成C,C能够与A反应生成CH3COOCH2=CH2,则C为CH3COOH、A为CH2=CH2;CH3COOCH2=CH2通过反应Ⅱ生成D、D与氢氧化钠溶液反应生成聚乙烯醇,再结合不饱和碳原子与羟基直接相连不稳定可知D的结构简式为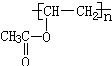 ,
,
聚乙烯醇结构简式为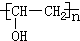 ,
,
(1)通过以上分析知,A为CH2=CH2,实验室用乙醇发生消去反应制取乙烯,反应方程式为C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH2=CH2;C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)聚乙烯醇结构简式为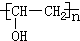 ,B是乙醛,可以用银氨溶液或新制氢氧化铜悬浊液检验,
,B是乙醛,可以用银氨溶液或新制氢氧化铜悬浊液检验,
故答案为: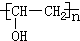 ;银氨溶液或新制氢氧化铜悬浊液;
;银氨溶液或新制氢氧化铜悬浊液;
(3)反应Ⅱ、Ⅲ的反应类型分别是聚合反应或加聚反应、水解反应,
故答案为:聚合反应或加聚反应;水解反应;
(4)与CH3COOCH=CH2含有的官能团相同的同分异构体,若为甲酸酯,可能的结构简式为:HCOOCH=CHCH3、HCOOCH2CH=CH3、HCOOC(CH3)=CH2;若为丙烯酸甲酯,其结构简式为:CH2=CHCOOCH3,所以总共有4种,故答案为:4;
(5)III的反应方程式为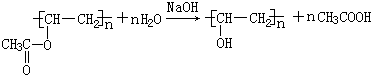 ,故答案为:
,故答案为: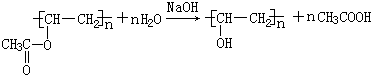 .
.
点评 本题考查有机物推断,为高频考点,涉及烯烃、醛、羧酸、酯之间的转化及加成反应、取代反应等知识点,正确判断A结构简式是解本题关键,注意题给信息的利用,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
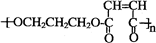 +2nH2O
+2nH2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
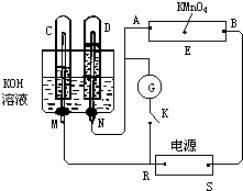
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则由水电离出的OH-为10-12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有氢原子的数目为NA | |
| C. | 50mL18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于海水的净化,但不能用于海水的淡化 | |
| B. | 使用清洁能源是防止酸雨的重要的措施 | |
| C. | 胃酸过多的病人均可服用含Al(OH)3或NaHCO3的药物进行治疗 | |
| D. | 84消毒液可用来漂白某些衣物,为加快漂白速度,使用时可加入少量稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向能使PH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量HClO溶液:2Fe2++HClO═2Fe3++Cl-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
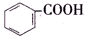 >H2CO3>
>H2CO3>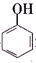 >HCO${\;}_{3}^{-}$,现将
>HCO${\;}_{3}^{-}$,现将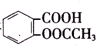 转变为
转变为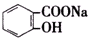 ,可行的方法是( )
,可行的方法是( )| A. | 向该溶液中加入足量的稀硫酸,加热 | |
| B. | 将该物质与稀硫酸共热后,再加入足量的NaOH溶液 | |
| C. | 将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液 | |
| D. | 将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com