
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
【答案】A
【解析】 A、因为Fe和盐酸反应氧化产物是Fe 2+ ,5.6 g铁失去电子数为0.2 N A,选项A错误;B、B. 标准状况下11.2L二氧化硫中含有的原子数为![]() 3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
【题型】单选题
【结束】
23
【题目】实验室利用以下反应制取少量氨气:NaNO2+NH4Cl=NaC1+N2↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3mol
C. NH4Cl中的氯元素被还原
D. N2既是氧化剂,又是还原剂
【答案】B
【解析】A、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NaNO2是氧化剂,发生还原反应,选项A错误;B.反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,化合价升高值=化合价降低值=转移电子数=3,即每生成1molN2时,转移电子的物质的量为3mol,选项B正确; C、NH4C1中的氯元素化合价不变,不被还原;氮元素化合价从-3价升为0价,所以NH4C1中的氮元素被氧化,选项C错误; D.反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NH4C1中的氮元素化合价从-3价升为0价,氮气既是氧化产物又是还原产物,选项D错误。答案选B。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH→CO(OCH3)2 + H2O 。某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )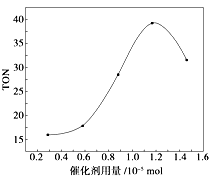
A.由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
B.在反应体系中添加合适的吸水剂,将提高该反应的TON
C.当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点
D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“侯氏制碱法”化学反应原理为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4C1,下图模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
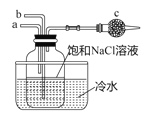
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH=7.8,已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法不正确的是( ) 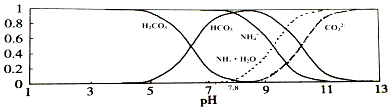
A.溶液的pH=9时,溶液中存在下列关系:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
C.由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Ka1(H2CO3)>Kb(NH3H2O)>Ka2(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程要分三步,完成下列填空。
(1)步骤一、灼烧干海带,使其灰化后用热水浸泡过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在___________(填写仪器名称)。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I—,制得富碘溶液。通适量氯气发生反应的离子方程式为___________________________。
(3)步骤三:取l00mL步骤二中富碘溶液,按如下流程分离碘单质。

酸化过程发生的反应是:5I—+IO3—+6H+=3I2+3H2O,则萃取Ⅱ发生的反应离子方程式为_________________________________________________________________________。
萃取剂X应选择____________________(选填編号)。
a.100mL苯 b.10mL乙醇 c.10mLCCl4
操作I的名称是______________________________。
(4)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程如下: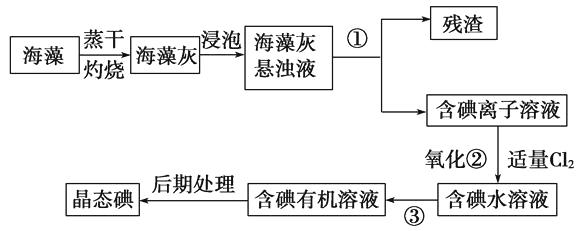
(1)指出提取碘的过程中有关的实验操作名称:
①、③。写出过程②中有关反应的离子方程式
;
(2)提取碘的过程中,可供选择的有机试剂是()
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是;
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出实验装置中的错误之处:①;②;③。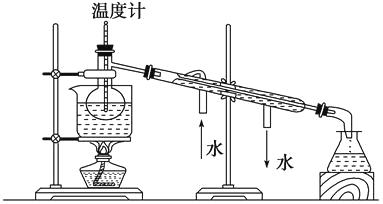
(5)进行上述蒸馏操作时,使用水浴的原因是 , 最后晶体碘在里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( )
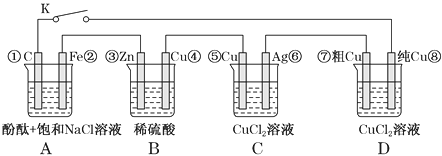
A. 当K断开时,B装置锌片溶解,有氢气产生
B. 当K闭合时,A装置发生吸氧腐蚀,在电路中作电源
C. 当K闭合后,C装置可作为电镀池装置
D. 当K闭合后,A、B装置中pH变大,C、D装置中pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3 . Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )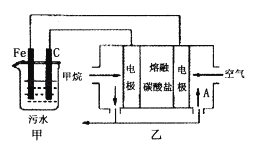
A.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
B.甲装置中阴极的反应为Fe﹣2e﹣═Fe2+
C.为了增加污水的导电能力,应向污水中如入适量的NaOH溶液
D.当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验现象描述错误的是( )
A.氯气作用于干燥的红纸条,红纸条不褪色
B.红热的铁丝在氯气中燃烧,产生棕黄色的烟
C.钠可以在氯气中燃烧,产生白烟
D.纯净的氢气可以在氯气中安静燃烧,产生淡蓝色火焰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com