


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
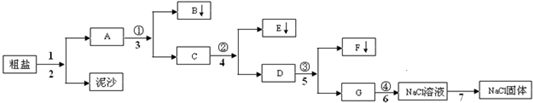
科目:高中化学 来源: 题型:
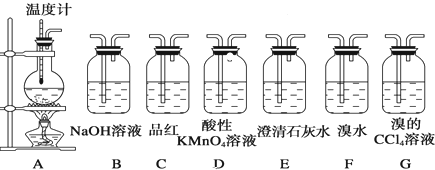
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| B、10 mL 0.02 mol?L-1 HCl溶液与10 mL 0.02 mol?L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| C、在0.1 mol?L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+) |
| D、0.1 mol?L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液中离子浓度大小关系为:c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B、发生反应生成的AgI沉淀多于AgCl沉淀 |
| C、在水中AgCl的溶解度比AgI的溶解度大 |
| D、若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
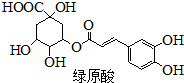 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A、奎尼酸分子式为C7H14O6 |
| B、绿原酸能发生取代、加成、消去和缩聚反应 |
| C、1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH |
| D、咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com