
 化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
化学兴趣小组的同学用0.100 0 mol/L 盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 |
| V(HCl)/mL | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 | |
| pH | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
分析 (1)根据配制一定物质的量浓度的溶液的配制步骤选择使用的仪器;
(2)①滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面,
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定,开始滴定前要调节液面于“0”刻度或“0”刻度以下;
(3)①根据表中数据可以绘制出中和滴定的曲线,注意PH突跃的理解应用:
②氢氧化钠溶液的浓度为:$\frac{0.1000mol/L×0.024L}{0.02L}$=0.1200mol/L,
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g,据此计算样品中NaOH的质量百分含量.
解答 解:(1)用2.50g含有少量杂质的固体烧碱样品配制500mL溶液,配制过程为:计算、称量、溶解、冷却、转移、洗涤、摇匀等,需要的仪器有托盘天平、烧杯、玻璃棒、量筒、500mL容量瓶、胶头滴管,需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要量筒和500mL容量瓶,
故答案为:500mL容量瓶、量筒;
(2)①滴定管在使用前应先检漏、洗涤、用待装液润洗、正式装液,排除气泡并调节液面,滴定管在使用前除洗涤外,还应检查滴定管是否漏水,洗净并用待盛装的溶液润洗滴定管2~3次;
故答案为:检查滴定管是否漏水,洗净并用待盛装的溶液润洗滴定管2~3次;
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定,开始滴定前要调节液面于“0”刻度或“0”刻度以下,
故答案为:调节液面于“0”刻度或“0”刻度以下;
(3)①根据表中数据可以绘制出中和滴定的曲线为: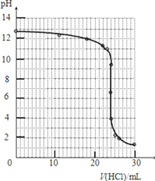 ,
,
故答案为: ;
;
②氢氧化钠溶液的浓度为:$\frac{0.1000mol/L×0.024L}{0.02L}$=0.1200mol/L,
样品中含有的氢氧化钠的物质的量为:0.1200mol/L×1L=0.12mol,氢氧化钠的质量为:40g/mol×0.12mol=4.800g,
故样品中,NaOH的质量百分含量为:$\frac{4.800g}{5.000g}$×100%=96%,
故答案为:96%.
点评 本题考查了中和滴定的实验分析判断,步骤和注意问题,滴定计算应用,测定混合物成分的方案设计与分析判断,图象绘制方法,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法的名称为2-甲基-3,5-二乙基乙烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 下列物质的沸点按由低到高顺序为:CH3(CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
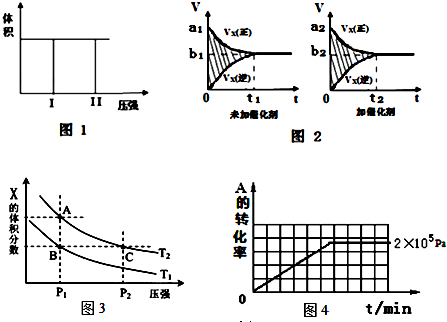
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
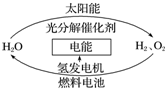 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )| A. | 氢能源已被普遍使用 | |
| B. | H2O的分解反应是吸热反应 | |
| C. | 氢气不易贮存和运输,无开发利用价值 | |
| D. | 2 mol 液态H2O具有的总能量高于2 mol H2和1 mol O2的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | Mg2+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com