
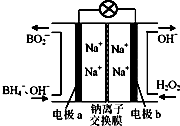
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A、电池放电时Na+从b极区移向a极区 |
| B、每消耗3 mol H2O2,转移的电子为3 mol |
| C、电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D、该电池的负极反应式为:BH4-+8OH--8e-=BO2-+6H2O |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、先装好药品,后检查装置的气密性 |
| B、先用双手握紧试管,后将导管插入水中以检查装置的气密性 |
| C、开始氢气还原氧化铜的实验时,先通入一段时间的氢气,再加热 |
| D、稀释硫酸时,先在烧杯里倒入水,再小心例入浓硫酸并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
| E、与铝反应产生H2的溶液中:NO3-、Na+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
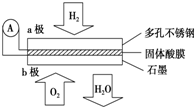 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A、电子通过外电路从b极流向a极 |
| B、b极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准下1.12 L的H2 |
| D、H+由b极通过固体酸电解质传递到a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| A、445.15kJ/mol |
| B、607.3kJ/mol |
| C、890.3kJ/mol |
| D、802.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HI的生成速率与H2的生成速率相等 |
| B、H2的生成速率与I2的生成速率相等 |
| C、混合物的颜色不再发生变化 |
| D、H2、I2、HI的分子数之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、它们都是吸热反应 |
| B、a、b和c均为正值 |
| C、a<b |
| D、2b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:
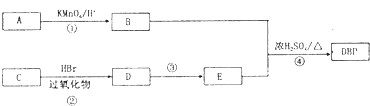 增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com