
| A. | 都可以 | B. | 只有①不能发生 | C. | 只有②不能发生 | D. | 只有①④不能发生 |
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水 | B. | NaOH | C. | Ba(OH)2 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
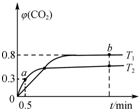 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若金属有剩余,向溶液中再滴入硫酸后,金属可能溶解,也可能不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | |
| D. | 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-$\frac{a}{3}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过足量溴水 | |
| B. | 通入足量的酸性高锰酸钾溶液 | |
| C. | 燃烧 | |
| D. | 使乙炔在一定条件下与氢气发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com