

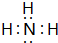 ,⑨的氢化物为HCl,二者反应生成氯化铵固体而产生白烟,氯化铵属于离子化合物,检验该盐溶液中阳离子存在的方法是:取少量溶液于试管中,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子,
,⑨的氢化物为HCl,二者反应生成氯化铵固体而产生白烟,氯化铵属于离子化合物,检验该盐溶液中阳离子存在的方法是:取少量溶液于试管中,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子,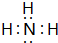 ;产生白烟;离子;取少量溶液于试管中,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子;
;产生白烟;离子;取少量溶液于试管中,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子;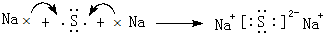 ,
,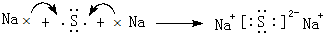 ;
;

科目:高中化学 来源: 题型:
 用18.4mol?L-1的浓硫酸配制100mL浓度为1mol?L-1的稀硫酸,其操作可分为以下各步:
用18.4mol?L-1的浓硫酸配制100mL浓度为1mol?L-1的稀硫酸,其操作可分为以下各步:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应:
在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-11m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com