
“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观象冰。1体积“可燃冰”可储藏100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是
| A.“可燃冰”有可能成为人类未来的重要能源 | B.“可燃冰”是一种比较洁净的能源 |
| C.“可燃冰”提供了水可能变成油的例证 | D.“可燃冰”的主要可燃成分是甲烷 |
科目:高中化学 来源: 题型:单选题
(14分)“氢能”将是未来最理想的新能源。
Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
Ⅱ 氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
(1)若升高温度至950℃,达到新平衡状态时K (填“>”、“<”或“=”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、1.0 molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③若设x="5.0" mol和x="6.0" mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a (填“>”、“<”或“=”)b。
Ⅲ 海水淡化获得淡水的过程也可以产生氢气。下面是利用电渗析法处理海水获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
(1)阳离子交换膜是指______________ (填A或B)。
(2)写出通电后阳极的电极反应式:_________________________________________,在阴极区观察到的现象是:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于热化学反应的描述中正确的是 ( )
| A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1 |
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+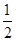 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则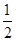 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应前后物质的总能量变化能用下图表示的是( )
| A.生石灰和水的反应 |
| B.石灰石在高温下的分解反应 |
| C.盐酸与氢氧化钠溶液的反应 |
| D.木炭在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式正确的是
| A.S(s)+O2(g)= SO2(g);ΔH= -269.8kJ/mol |
| B.NaOH (aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.3kJ/mol |
| C.表示乙醇的燃烧热:C2H5OH(l)+3O2(g)=2CO2(g)+ 3H2O(g);ΔH=-1367.0 kJ/mol |
| D.2NO2 = O2+2NO;ΔH= +116.2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)= Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com