
【题目】某兴趣小组设计步骤用滴定法测定AgBrO3的溶度积常数.回答下列问题:
步骤I:试剂的配制
分别配制1L0.025molL-1KBrO3溶液、1L0.025rrolL-1AgNO3溶液、lL0.05molL-1Na2S2O3溶液。
(1)配制Na2S2O3溶液所使用的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除______________(写名称)及二氧化碳。
步骤II:AgBrO3饱和溶液配制
用棕色滴定管量取20.00mL0.025molL-1AgNO3溶液于干燥的锥形瓶中,然后用另一支滴定管量取20.00mL0.025molL-1KBrO3溶液注入到锥形瓶中,摇动锥形瓶使沉淀完全,把沉淀陈化3~5min,用过滤器过滤,滤液用于燥洁净的小烧杯盛接。
(2)量取AgNO3溶液所使用的滴定管为棕色的目的是______________。
(3)如果滤液浑浊需要进行的操作为______________。
步骤III:AgBrO3饱和溶液中BrO3-浓度的测定
准确量取20.00mL所得滤液注入碘量瓶中,再加入20mL10%的KI溶液、l5mLlmolL-1的硫酸并加50.00rnL水混匀,放置3~5min,以淀粉为指示剂,用Na2S2O3溶液滴定,消耗Na2S2O3溶液17.86mL(发生的反应BrO3-+6H++6I-=Br-+3I2+3H2O;2Na2S2O3+I2=Na2S4O6+2NaI)。
(4)滴定到终点时的现象为______________。
(5)滤液中BrO3-的浓度为______________(保留3位有效数字,下同),AgBrO3的溶度积测定值为______________。
(6)步骤II中滤液若没有澄清,会使测量值______________(填“偏高”“偏低”或“无影响”,下同);盛接滤液的小烧杯中有少量水存在,会使测量值________。
【答案】氧气 防止AgNO3溶液见光分解 重新过滤 滴入最后一滴标准溶液,蓝色刚好褪去,且半分钟内不恢复原色(或其他合理表述) 7.44×l0一3molL-1 5.54×l0一5 偏高 偏低
【解析】
(1)配制具有还原性的物质,为了防止其被氧化,因此需要将蒸馏水煮沸,冷却室温,在溶解;
(2)对于见光易分解的物质,通常保存在棕色试剂瓶中,滴定操作时,对于见光易分解的物质,应使用棕色滴定管;
(3)根据滤液依旧浑浊,说明没有过滤干净,滤液中有滤渣;
(4)根据I2能使淀粉溶液变蓝,判断滴定终点;
(5)根据发生的反应有BrO3-+6H++6I-=Br-+3I2+3H2O、2Na2S2O3+I2=Na2S4O6+2NaI,因此由方程式确定关系式为![]() ,根据关系式法,确定的BrO3-浓度,然后计算AgBrO3的溶度积;
,根据关系式法,确定的BrO3-浓度,然后计算AgBrO3的溶度积;
(6)误差分析,分析消耗Na2S2O3溶液体积是偏大还是偏小。
(1)配制Na2S2O3溶液,应避免Na2S2O3被氧化,故配制Na2S2O3溶液所使用的蒸馏水必须经过煮沸,可以除去蒸馏水中溶解的氧气、二氧化碳等;
(2)AgNO3见光易分解,故量取AgNO3溶液所使用的滴定管为棕色的目的是防止AgNO3溶液见光分解;
(3)滤液浑浊说明没有过滤干净,需要重新过滤;
(4)碘遇淀粉变蓝,当I2全被Na2S2O3还原为I-时,溶液蓝色消失,故滴定到终点时的现象为当滴入最后一滴标准溶液,蓝色刚好褪去,且半分钟内不恢复原色;
(5)发生的反应有BrO3-+6H++6I-=Br-+3I2+3H2O、2Na2S2O3+I2=Na2S4O6+2NaI,因此由方程式确定关系式为BrO3- ~ 3I2 ~ 6Na2S2O3,Na2S2O3的物质的量为0.05molL-1×0.01786L=0.00893mol,c(BrO3-)= =0.00744molL-1,AgBrO3的溶度积为0.00744×0.00744=5.54×10-5;
=0.00744molL-1,AgBrO3的溶度积为0.00744×0.00744=5.54×10-5;
(6)步骤II中滤液若没有澄清,则AgBrO3过量,参与反应,消耗Na2S2O3溶液的体积偏大,则滴定结果偏高,盛接滤液的小烧杯中有少量的水存在,则c(BrO3-)偏小,会使测定值偏低。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有机物说法不正确的是( )
A. 对甲基苯乙烯中最多有17个原子共面
B. 萘环(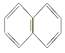 )上的一个H原子被-C4H9取代后的产物共有8种
)上的一个H原子被-C4H9取代后的产物共有8种
C. BrCH2CHBrCH2Br的名称为三溴丙烷
D. 立方烷(![]() )一氯代物1种、二氯代物有3种、三氯代物也有3种
)一氯代物1种、二氯代物有3种、三氯代物也有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有VO2+和Cr2O72-,现向其溶液中滴入29.00mL0.1mol/L的FeSO4溶液,恰好是VO2+→VO2+,Cr2O72-→Cr3+.再滴入2.OOmL0.02000mol/L的KMnO4溶液,又恰好是VO2+→VO2+,而Cr3+不变,此时MnO4-→Mn2+,则原溶液中Cr元素的质量为
A.156 mgB.23 4 mgC.31.2 mgD.46.8mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,还含有少量SiO2、Fe2O3)为主要原料制备高性能的磁性材料碳酸猛(MnCO3)。其工业流程如图所示,下列说法错误的是
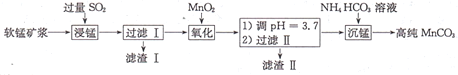
A.滤渣I可用于制造光导纤维、滤渣II可用于制作颜料
B.“浸锰”过程MnO2参与反应的化学方程式为MnO2十SO2=MnSO4
C.“沉锰”时,反应体系的温度越高,越有利于生成MnCO3
D.检验高纯碳酸锰是否洗涤干净,可选用BaCl2溶液和盐酸试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(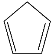 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g)=
(g)= ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g)=
(g)+ I2(g)=![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
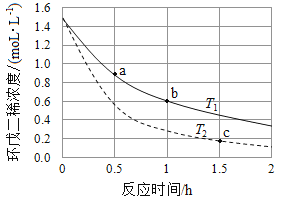
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
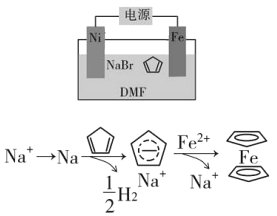
该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
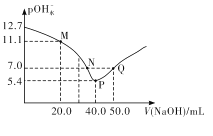
A.水的电离程度:M>PB.图中P点至Q点对应溶液中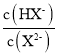 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化的PbO2、还有组成类似Fe3O4的Pb3O4 ,请将Pb3O4 改写成简单氧化物的形式: _________。
II.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO 、PbO2、PbSO4等)为原料,制备超细PbO ,实现铅的再生利用。其工作流程如下:
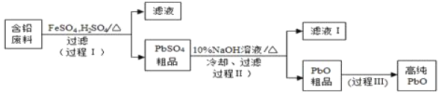

(2)步骤① 的目的是“脱硫”,即将PbSO4转化PbSO3,反应的离子方程式为_______________________。
“脱硫过程”可在如图所示的装置中进行,实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h.。
①仪器a的名称是 __________;转化温度为35 ℃, 采用的合适加热方式是________。
②步骤②中H2O2的作用是 __________________ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A _____________(填装置字母代号),证明产物中有CO气体的实验现象是________________。

(4)测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000molL-1的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+ (反应方程式为Pb2++H2Y2-= PbY2- +2H+,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL
①若滴定管未用 EDT A 标准液润洗,测定结果将_________ (填“偏高” “偏低” 或“不变”)。
②草酸铅的纯度为 __________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列过程的化学用语表述正确的是
A. 用硫酸铜溶液除去乙炔中的硫化氢气体:H2S + Cu2+=== CuS↓ + 2H+
B. 向氯化铝溶液中滴入过量氨水:Al3+ + 4OH- === AlO2- + 2H2O
C. 用电子式表示Na和Cl形成NaCl的过程:![]()
D. 钢铁发生电化学腐蚀的正极反应:Fe-3e- === Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com