
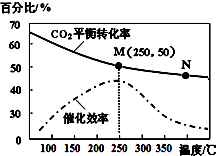
 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )| A. | 该反应的逆反应为吸热反应 | |
| B. | 平衡常数:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 当温度高于250℃,升高温度,催化剂的催化效率降低 |
分析 A、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动;
C、温度升高化学反应速率加快,催化剂的催化效率降低;
D、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动.
解答 解:A、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,则逆反应为吸热反应,故A正确;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故B正确;
C、化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(N)有可能小于v(M),故C错误;
D、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,故D正确;
故选C.
点评 本题考查了图象分析化学反应速率的影响因素、平衡计算、平衡移动等,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 反应温度 (℃) | 参加反应的物质 | H2O体积(mL) | |||
| Na2S2O3 | H2SO4 | |||||
| 体积(mL) | 浓度(mol.L-1) | 体积(mL) | 浓度(mol.L-1) | |||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求完成下列填空:
按要求完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A. | 由Q与Y形成的化合物中可能存在共价键 | |
| B. | Z与X之间形成的化合物具有还原性 | |
| C. | 由X、Y、Z三种元素形成的化合物,其晶体可能是离子晶体 | |
| D. | Y与W形成的化合物中,Y显负价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱.
如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| 物质鉴定试验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为CO32-、OH-,C、D、E中含有的阳离子为H+、Al3+、Ag+ |
| ②A溶液与E溶液反应,既有气体产生又有沉淀产生,A与C反应只有气体产生 | A为Na2CO3,C含H+ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com