
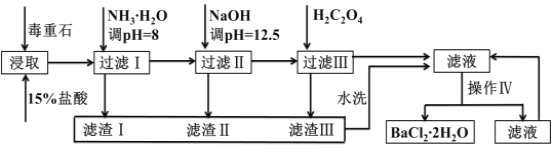
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀的pH | 11.9 | 9.1 | 1.9[ |
完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_______ __
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有______________(至少两条)。
(2)加入氨水调节溶液pH=8的目的是___________________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是___ __ ____________。
(3)操作Ⅳ的步骤是:______ ______、过滤。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H2O ;Ba2++CrO42— =BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
通过计算,氯化钡溶液浓度为___________mol·L-1(用含字母的式子表示)。
【答案】(1)d; 研磨成粉、加热、搅拌;(2)使Fe3+形成Fe(OH)3沉淀而除去;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少。(3)蒸发浓缩、冷却结晶;(4)b(V0-V1)/y
【解析】
试题分析:(1)实验室用37%的盐酸配制1mol/L盐酸,根据配制溶液的实验步骤确定所需仪器。量取浓盐酸用到量筒,溶解用到烧杯、玻璃棒,移液用到容量瓶,不需要滴定管,选d;为了加快毒重石的酸浸速率,可以采取的措施有研磨成粉、加热、搅拌。
(2)分析题给流程和数据知加入氨水调节溶液pH=8的目的是使Fe3+形成Fe(OH)3沉淀而除去;加入氢氧化钠溶液调节溶液pH=12.5的目的是使Mg2+形成Mg(OH)2沉淀而除去,Ca2+部分转化为氢氧化钙沉淀,故滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入H2C2O4的目的是除去Ca2+,草酸应避免过量,原因是H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少。
(3)操作Ⅳ为从氯化钡溶液中得到氯化钡晶体,操作步骤是:蒸发浓缩、冷却结晶、过滤。
(4)根据题意知与Ba2+反应的CrO42的物质的量为(V0b—V1b)/1000mol,则Ba2+浓度为(V0b—V1b)/y。


科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验的分析不正确的是
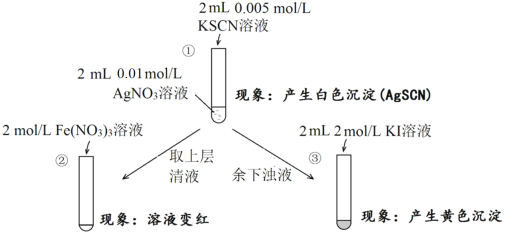
A.①浊液中存在平衡:AgSCN(s)![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )
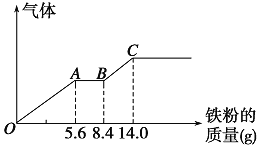
A.H2SO4浓度为2.5 mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO![]() 物质的量为0.1 mol
物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[有机化学基础]用乙烯、甲苯、E三种原料合成高分子药物M和有机中间体L的路线如下:
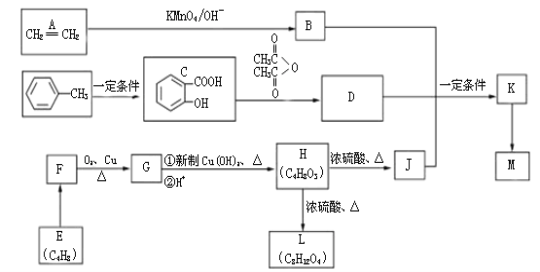
已知:

III .有机物L是一种六元环酯,M的分子式是(C15H16O6)n
(1)C中含氧官能团的名称____ ____,D的结构简式_______________。
(2)E在KMO4/OH- 中转化成F,F的结构简式_________________,H→J的反应类型______________。
(3)H→L的化学反应方程式是_________________________。
(4)K→M属于加聚反应,K的结构简式是____ ____。
(5)写出一定量的C与足量NaOH溶液反应的化学方程式 。
(6)写出一种符合下列条件的C的同分异构体的结构简式____ ___。
① 属于芳香族化合物;② 能发生银镜反应;③ 遇FeCl3溶液能发生显色反应;④ 核磁共振氢谱有4组峰,且峰面积之比为l:l:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在指定溶液中一定能大量共存的是
A.加入Al能放出H2的溶液中:Fe2+、K+、NO![]() 、Cl-
、Cl-
B.在pH=13的溶液中:Na+、AlO2-、NO![]() 、S2-、SO
、S2-、SO![]()
C.由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、NO![]() 、NH
、NH![]() 、F-
、F-
D.NaHCO3溶液中:K+、Na+、SO![]() 、Al3+
、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列元素全部是微量元素的一组是
①K、S、Ca、Fe ②Mg、N、Mn、B ③Fe、Mn、B、Zn ④P、S、B、Mo
A. ① B. ② C. ③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有 性。
(3)在人体中进行Fe2+![]() Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为___________________________,离子方程式为_________________________。
(5)己知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1 molO2转移电子的物质的量为__________,反应①、②的总反应方程式为______________________,
在该反应中Fe3+的作用为________________。
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现了___________性和_____________ 性,毎有1 molFe参加反应转移电子______________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com