
| A. | 原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为碳元素;W与X同主族,所以W是Si元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg,以此解答该题.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为碳元素;W与X同主族,所以W是Si元素;Y是地壳中含量最高的元素,则Y为氧元素,Z2+与Y2-具有相同的电子层结构,离子核外电子数为10,故Z的质子数为12,则Z为Mg.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:r(Mg)>r(Si)>r(C)>r(O),故A正确;
B.Y和Z、W形成的化合物为MgO、SiO2,MgO、SiO2中存在的化学键分别是离子键、共价键,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性X(C)>W(Si),所以X的最高价氧化物对应水化物的酸性比W的强,故C正确;
D.元素的非金属性越强,其气态氢化物的稳定性越强,非金属性Y(O)>W(Si),所以Y的气态简单氢化物的热稳定性比W的强,故D正确;
故选B.
点评 本题考查原子结构和元素周期律,明确物质结构、元素周期律即可解答,熟练掌握同一周期、同一主族元素性质递变规律,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 有AgCl沉淀析出 | B. | 无AgCl沉淀 | ||
| C. | 无法确定 | D. | 有沉淀但不是AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯发生的是取代反应 | |
| C. | C5H10不属于烷烃,而C5H12属于烷烃且有3种同分异构体 | |
| D. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
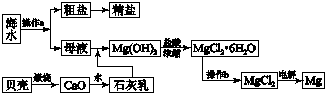
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| D. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物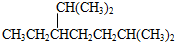 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使高锰酸钾溶液褪色 | |
| D. | 结构片段为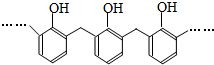 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 | / |
| 步骤2:取适量步骤1滤液于试管中,滴加稀硫酸 | 生成白色沉淀,说明该试剂中含有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,… | …,说明该试剂中含有BaCO3 |
| 步骤4:… | … |
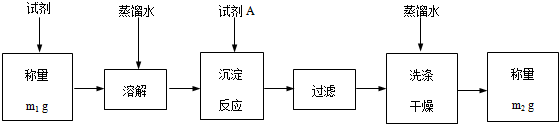
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com