
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
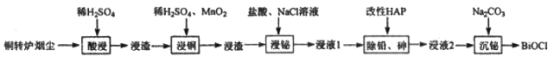
请回答:
(1)Bi位于第六周期,其原子结构示意图为__________________________________。
(2)向“酸浸”所得浸液中加入Zn粉,充分反应后过滤,从溶液中获得ZnSO4·7H2O的操作为__________、过滤、洗涤、干燥。
(3)“浸铜”时,有单质硫生成,其离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“除铅、砷”时,可以采用以下两种方法。
①加入改性HAP。浸液1与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125:1 | 50:1 | 25:1 | 15:1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=_________________________。
②铁盐氧化法,向浸液1中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。欲使溶液中c(AsO42-)<10-9mol/L且不产生Fe(OH)3沉淀,应控制pH的范围为__________。
已知:1g2=0.3:;FeAsO4、Fe(OH)3的Ksp分别为5×10-23、4×10-38。
(6)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________________。
【答案】 ![]() 蒸发浓缩、冷却结晶 CuS+MnO2+4H+=Cu2++Mn2++S+2H2O 温度升高,盐酸挥发,反应物浓度降低 50︰1 pH<5.3 BiCl3+Na2CO3 = BiOCl↓+2NaCl+CO2↑
蒸发浓缩、冷却结晶 CuS+MnO2+4H+=Cu2++Mn2++S+2H2O 温度升高,盐酸挥发,反应物浓度降低 50︰1 pH<5.3 BiCl3+Na2CO3 = BiOCl↓+2NaCl+CO2↑
【解析】考查化学工艺流程,(1)Bi位于第六周期VA族,原子序数为83,其原子结构示意图为![]() ;(2)获得带有结晶水的物质时,一般采用蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥;(3)浸铜时加入的物质是MnO2、稀硫酸、滤渣,得到单质硫,有:MnO2+H++CuS→S↓+Mn2++Cu2++H2O,然后根据化合价升降法进行配平,离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O;(4)浸铋时所加物质为盐酸和NaCl溶液,盐酸易挥发,温度升高,HCl挥发,反应物浓度降低;(5)①根据表格数据,L/S=50:1以后,Pb2+、As3+去除率虽然增加,但Pb2+、As3+去除率变化都不大,因此为了节省能源以及原料,L/S控制在50:1;②c(AsO43-)=10-9mol·L-1,此时c(Fe3+)=Ksp(FeAsO4)/c(AsO43-)=5×10-21/10-9mol·L-1=5×10-12mol·L-1,此时c(OH-)=
;(2)获得带有结晶水的物质时,一般采用蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥;(3)浸铜时加入的物质是MnO2、稀硫酸、滤渣,得到单质硫,有:MnO2+H++CuS→S↓+Mn2++Cu2++H2O,然后根据化合价升降法进行配平,离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O;(4)浸铋时所加物质为盐酸和NaCl溶液,盐酸易挥发,温度升高,HCl挥发,反应物浓度降低;(5)①根据表格数据,L/S=50:1以后,Pb2+、As3+去除率虽然增加,但Pb2+、As3+去除率变化都不大,因此为了节省能源以及原料,L/S控制在50:1;②c(AsO43-)=10-9mol·L-1,此时c(Fe3+)=Ksp(FeAsO4)/c(AsO43-)=5×10-21/10-9mol·L-1=5×10-12mol·L-1,此时c(OH-)=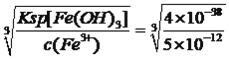 =2×10-9mol·L-1,此时的pH=5.3,即pH<5.3;(6)沉铋时,加入的物质是Na2CO3,生成的BiOCl,因此有BCl3+Na2CO3→BiOCl,根据反应特点,产物还有NaCl和CO2,化学方程式为 BiCl3+Na2CO3 = BiOCl↓+2NaCl+CO2↑。
=2×10-9mol·L-1,此时的pH=5.3,即pH<5.3;(6)沉铋时,加入的物质是Na2CO3,生成的BiOCl,因此有BCl3+Na2CO3→BiOCl,根据反应特点,产物还有NaCl和CO2,化学方程式为 BiCl3+Na2CO3 = BiOCl↓+2NaCl+CO2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是( )
A.化学反应必然伴随能量变化
B.化学变化中的能量变化主要是由化学键变化引起的
C.化学反应中的能量变化的大小与反应物的质量多少无关
D.能量变化是化学变化的基本特征之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 molL﹣1盐酸
D.提高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用物质的量浓度为0.100 0molL﹣1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液 , 立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是(填序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若某次滴定结束时,酸式滴定管中的液面如图所示,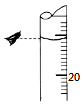
则读数为 mL.若仰视,会使读数偏(填“大”或“小”).
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是 molL﹣1 .
滴定 | 待测溶液 | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | 1.34 | 19.39 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电化学原理在铝表面形成氧化膜来提高其抗腐蚀能力,工作原理如图所示。下列说法不正确的是

A. 碳棒可用铜棒代替,其作用是传递电流
B. 通电一段时间后,溶液的pH减小
C. 通电后电子被强制从碳棒流向铝片使铝表面形成氧化膜
D. 可通过调节滑动变阻器来控制氧化膜的形成速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]2017年治疗膀胱癌的有机小分子药物Aminolevulinic acid被批准使用,其合成路线如下:

已知:
请回答:
(1)A的名称为________,G中含氧官能团的名称为____________________________。
(2)⑤的反应类型为____________________,H的分子式为_____________________________。(3)①的化学方程式为__________________________________________。
(4)④的化学方程式为______________________________________________。
(5)D的同分异构体中,同时满足下列条件的共有____种(不含立体异构);
a.能与Na反应产生气体
b.既能发生银镜反应,又能发生水解反应
其中核磁共振氧谐有4组峰的物质的结构简式为________________(任写一种)。
(6)参照上述合成路线,设计由2-甲基丙酸和甲醇为起始原料制备2-甲基丙烯酸甲酯的合成路线(无机试剂任选)______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知破坏1mol H﹣H键、1mol I﹣I键、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成2mol HI需要放出kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
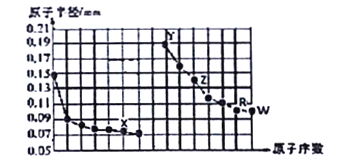
A. X所在主族中,X的简单氢化物分子间存在氢键,所以其氢化物稳定性最强
B. R简单氢化物的酸性弱于W简单氢化物,故元素非金属性R小于W
C. 在同周期中,W的含氧酸酸性最强
D. 已知Z的一种金属储氢材料LiZH4(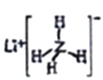 )遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
)遇水剧烈反应放出H2,则反应方程式为:LiZH4+2H2O=LiZO2+4H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com