
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图: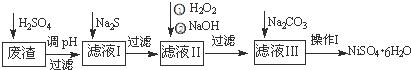
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
【知识点】工艺流程题 B1 B3 J1
【答案解析】(1)S2-+Cu2+===CuS↓
(2)减少(防止)过氧化氢的分解
(3)6Fe2++ ClO3-+6H+===6Fe3++Cl-+3H2O
(4))Na2SO4、NiSO4
(5)蒸发浓缩 冷却结晶
解析:⑴Na2S与Cu2+反应生成沉淀:S2-+Cu2+===CuS↓
⑵H2O2温度过高会发生分解
⑶氯酸钠将Fe2+氧化为Fe3+,本身被还原为Cl-,根据得失电子相等Fe2+与 ClO3-的物质的量之比为6:1.
⑷从整个流程看引入了钠离子,SO42-,除去了最后Cu、Zn、Fe、Cr等杂质,得到NiSO4•6H2O,因此滤液Ⅲ的主要成分是Na2SO4、NiSO4
⑸根据洗涤后获得NiSO4•6H2O,则之前的操作是蒸发浓缩 冷却结晶
【思路点拨】对于结晶水合物的析出一般是采取蒸发浓缩、冷却结晶的方法;流程中发生的化学变化则可根据流程中所加的物质及原料的成分判断。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
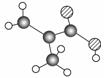
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
(1)该物质的结构简式为
________________________________________________________________________。
(2)该物质中所含官能团的名称为________________________。
(3)下列物质中,与该产品互为同系物的是(填序号)________,互为同分异构体的是__________。
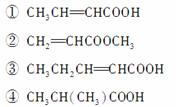
查看答案和解析>>
科目:高中化学 来源: 题型:
下列烷烃的名称是否正确?若不正确请改正。
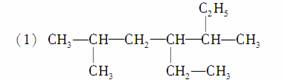
2甲基4,5二乙基己烷
________________________________________________________________________;
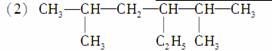
2,5二甲基4乙基己烷
________________________________________________________________________;
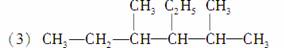
3乙基2,4二甲基己烷
________________________________________________________________________;
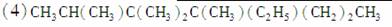
2,3,3,4,5五甲基4乙基己烷
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
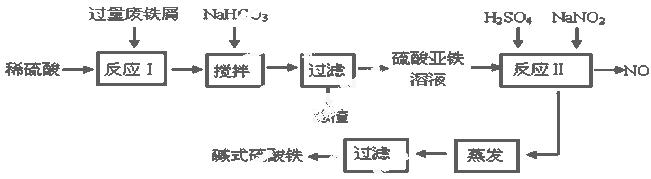
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,对于该反应,下列判断正确的是
A. NaN3中氮元素的化合价为-3
B.氧化剂和还原剂是同一物质
C.反应过程中若转移1mol电子,则产生2.24L气体(标准状况)
D.被氧化的氮原子与生成的氮气分子个数之比为15:8
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
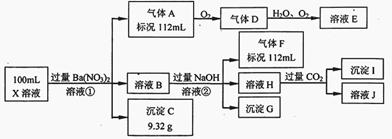
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:
Br-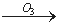 BrO-
BrO-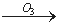 BrO2-
BrO2-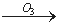 BrO3-,下列有关说法正确的是 ( )
BrO3-,下列有关说法正确的是 ( )
A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理
B.若改用氧气消毒,可避免生成溴酸盐
C.BrO3- 氧化性比O3强
D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中操作或现象能达到预期实验目的的是 ( )
| 选项 | 实验目的 | 操作或现象 |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| D | 证明溶液中存在平衡: Fe3++3SCN-Fe(SCN)3 | 将1 mL KSCN溶液与1 mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com