
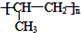 .
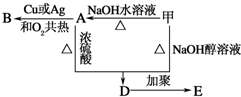
. 分析 甲的分子式为C3H7Br,在氢氧化钠的醇溶液、加热条件下发生消去反应生成D为CH3CH=CH2,D发生加聚反应生成E的结构简式为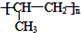 .
.
(1)甲在氢氧化钠的水溶液、加热条件下发生水解反应生成A,A氧化生成B,若B能发生银镜反应,则甲为CH3CH2CH2Br,A为CH3CH2CH2OH,B为CH3CH2CHO;
(2)若B不能发生银镜反应,则甲为CH3CHBrCH3,A为CH3CH(OH)CH3,B为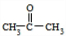 .
.
解答 解:甲的分子式为C3H7Br,在氢氧化钠的醇溶液、加热条件下发生消去反应生成D为CH3CH=CH2,D发生加聚反应生成E的结构简式为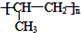 .
.
(1)甲在氢氧化钠的水溶液、加热条件下发生水解反应生成A,A氧化生成B,若B能发生银镜反应,则甲为CH3CH2CH2Br,A为CH3CH2CH2OH,B为CH3CH2CHO.
①有机物甲的结构简式为CH3CH2CH2Br,
故答案为:CH3CH2CH2Br;
②甲→A的化学方程式为:CH3CH2CH2Br+NaOH$\stackrel{△}{→}$CH3CH2CH2OH+NaBr,
B和银氨溶液反应的化学方程式为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+3NH3+2Ag↓+H2O,
故答案为:CH3CH2CH2Br+NaOH$\stackrel{△}{→}$CH3CH2CH2OH+NaBr;CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+3NH3+2Ag↓+H2O;
(2)若B不能发生银镜反应,则甲为CH3CHBrCH3,A为CH3CH(OH)CH3,B为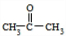 .
.
①A的结构简式为:CH3CH(OH)CH3,
故答案为:CH3CH(OH)CH3;
②甲+NaOH$→_{△}^{醇}$D的反应方程式为:CH3CHBrCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaBr+H2O,
D→E的反应方程式为:nCH3CH=CH2$\stackrel{催化剂}{→}$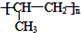 ,
,
故答案为:CH3CHBrCH3+NaOH$→_{△}^{醇}$CH3CH=CH2↑+NaBr+H2O;nCH3CH=CH2$\stackrel{催化剂}{→}$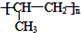 .
.
点评 本题考查了有机物的推断,关键是明确C3H7Br有2种同分异构体,再结合反应条件进行推断,熟练掌握有机物的官能团性质,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
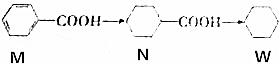
| A. | 浓硫酸加热的条件下,1mol M与1mol CH3CH2OH混合,可生成1mol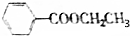 | |
| B. | 等质量的M、N、W分别在氧气中完全燃烧,W的耗氧量最大 | |
| C. | N的一氯代物有3种同分异构体(不考虑立体异构) | |
| D. | W分子中所有碳原子一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H5OH | C. | C3H8O | D. | C3H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡.
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体.甲、乙两位同学发现往水中投入过氧化钙时产生气泡.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
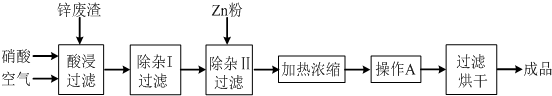
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是易导电的银白色金属 | B. | Tl(OH)3是两性氢氧化物 | ||
| C. | Tl3+能形成+3价的化合物 | D. | 单质能与稀硝酸反应生成硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol N2 | B. | 含NA个分子的Cl2 | ||
| C. | 标准状况下11.2 L的CH4 | D. | 6 g H2 (H2摩尔质量为2 g•mol-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g | B. | 4.4 g | ||
| C. | 5.6 g | D. | 在2.8 g和5.6 g之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com