
 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示.分析 根据图片知,0-20mL时没有沉淀生成,说明此时发生的反应为酸碱中和反应O H++OH-=H2O,20-160mL时随着NaOH的加入沉淀的量逐渐增加,此时发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,160-180mL时,随着NaOH的增加,沉淀的量减少,说明发生反应Al(OH)3+OH-=AlO2-+2H2O,所以m[Al(OH)3]=(19.4-11.6)g=7.8g,n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol,n[Mg(OH)2]=$\frac{11.6g}{58}$=0.2mol,
(1)根据Mg原子守恒计算n(Mg),再根据m(Mg)=nM计算镁质量;
(2)根据Al原子守恒计算n(Al),再根据m(Al)=nM计算Al质量;
(3)160mL时,溶液中的溶质为NaCl,根据原子守恒计算c(HCl).
解答 解:根据图片知,0-20mL时没有沉淀生成,说明此时发生的反应为酸碱中和反应O H++OH-=H2O,20-160mL时随着NaOH的加入沉淀的量逐渐增加,此时发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,160-180mL时,随着NaOH的增加,沉淀的量减少,说明发生反应Al(OH)3+OH-=AlO2-+2H2O,所以m[Al(OH)3]=(19.4-11.6)g=7.8g,n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol,n[Mg(OH)2]=$\frac{11.6g}{58}$=0.2mol,
(1)根据Mg原子守恒得n(Mg)=n[Mg(OH)2]=$\frac{11.6g}{58}$=0.2mol,m(Mg)=nM=0.2mol×24g/mol=4.8g,
故答案为:4.8;
(2)根据Al原子守恒得n(Al)=n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol,m(Al)=nM=0.1mol×27g/mol=2.7g,
故答案为:2.7;
(3)160mL时,溶液中的溶质为NaCl,根据原子守恒得n(NaCl)=n(HCl)=n(NaOH)=0.16L×5mol/L=0.8mol,c(HCl)=$\frac{0.8mol}{0.1L}$=8mol/L,
故答案为:8.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确各个顶点溶液中物质成分及发生的反应是解本题关键,结合原子守恒解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
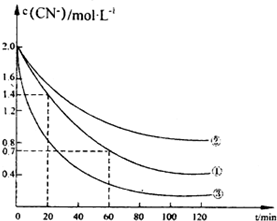 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将足量Cl2通入溴化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | AlCl3溶液中通入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 碳酸氢钠和稀硫酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
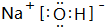 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | H2SO4 | C. | HClO4 | D. | MgSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com