
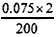 ��1000��0.75��mol/L��
��1000��0.75��mol/L��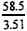 ��2.40��40g/mol
��2.40��40g/mol 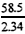 ��2.32��58g/mol
��2.32��58g/mol 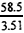 ��3.48��58g/mol
��3.48��58g/mol 


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������/g | 10.00 | 20.00 | 30.00 | 50.00 |
| Ũ�������ӵ�����/g | m | m | 1.29 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���������mL�� | 8 | 15 | 20 | 50 | x | 120 | 150 |
| ����CO2�����mL�� | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ǻ��õļ����Ԫ�أ��Ƽ��仯�������������������й㷺��Ӧ�á�
������м��㣺
57����������(NaN3)��ײ����ȫ�ֽ�����ƺ͵������ʿ�Ӧ����������ȫ���ҡ�������40.32 L(��״����)������������Ҫ��������___g��
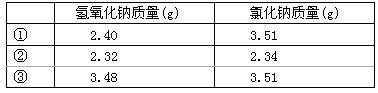
58����-�غϽ���ں˷�Ӧ���������Ƚ���Һ��5.05 g��-�غϽ�����200 mLˮ����0.075 mol������
(1)������Һ�����������ӵ����ʵ���Ũ��(������Һ����仯)��
(2)���㲢ȷ������-�غϽ�Ļ�ѧʽ��
59������������Һ�����������ˣ��õ��������Ƶ���Һ�������Һ��ͨ�������̼�������з�Ӧ��
2NaAl(OH)4+CO2��2Al(OH)3�� +Na2CO3+H2O
��֪ͨ�������̼336 L(��״����)������24 mol Al(OH)3��15 mol Na2CO3����ͨ����Һ�Ķ�����̼Ϊ112L����״����)���������ɵ�Al(OH)3��Na2CO3�����ʵ���֮�ȡ�
60�������£���ȡ��ͬ����������Ʒ����ˮ���������к���pH=7��Ȼ����Һ���ɵ��Ȼ��ƾ��壬���ɹ����в�Ʒ����ʧ��
| �� | ������������(g) | �Ȼ�������(g) |
| �� | 2.40 | 3.51 |
| �� | 2.32 | 2.34 |
| �� | 3.48 | 3.51 |
����ʵ��٢ڢ������������ƾ��������ʣ���ʵ�����ݿɿ���ͨ�����㣬�����ͱȽ��ϱ�3�����ݣ��������ۡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��г�����������ѧ����ĩ��ѧ�������л�ѧ�Ծ��������棩 ���ͣ�������
���ǻ��õļ����Ԫ�أ��Ƽ��仯�������������������й㷺��Ӧ�á�
������м��㣺
��1���������ƣ�NaN3����ײ���ֽ�����ƺ͵������ʿ�Ӧ����������ȫ���ҡ���78�˵���������ȫ�ֽ⣬������״���µ���___________________L ��
��2����-�غϽ���ں˷�Ӧ���������Ƚ���Һ��5.05 g��-�غϽ�����200 mLˮ����0.075 mol������������Һ���������Ƶ����ʵ���Ũ��______________________������Һ������仯����
��3������������Һ�����������ˣ��õ��������Ƶ���Һ�������Һ��ͨ�������̼�������з�Ӧ�� 2NaAl(OH)4+CO2��2Al(OH)3��+Na2CO3+H2O����֪ͨ�������̼112 L����״���£������ɵ�Al(OH)3��Na2CO3�����ʵ���֮��Ϊ4:5���������Һ��ͨ��Ķ�����̼Ϊ224L����״���£����������ɵ� Al(OH)3��Na2CO3�����ʵ��������ֵ��
��4��Ϊ�ⶨij�������պ�������������������е�Ԫ�ص������������ֽ���ͬ��������ι���ֱ���뵽50.00mL��ͬŨ�ȵ�����������Һ�У���ˮԡ����������ȫ���ݳ�(���¶�����β��ֽ�)�������徭�������Ũ����������ȫ���ⶨŨ�������ӵ����������ֲⶨ������±���
|
������/g |
10.00 |
20.00 |
30.00 |
50.00 |
|
Ũ�������ӵ�����/g |
m |
m |
1.29 |
0 |
�Իش�
����εijɷ�Ϊ_______________________________��
������е�Ԫ�ص���������Ϊ��_______________________________(����ʽ���㣩��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com