
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16g CH4所含原子数目为NA | ||
| C. | 17gNH3所含中子数目为10 NA | D. | 20g重水(D2O)所含质子数目为10NA |
分析 A、镁的物质的量=$\frac{m}{M}$,镁原子含有12个电子;
B、物质的量=$\frac{m}{M}$,甲烷分子中含有4个原子;
C、物质的量=$\frac{m}{M}$,氨气分子中含中子数为7;
C、物质的量=$\frac{m}{M}$,D2O中含有质子数为10.
解答 解:A、镁的物质的量=$\frac{m}{M}$=$\frac{2.4g}{24g/mol}$=0.1mol,1个镁原子含有12个电子,0.1mol金属镁所含电子数目为1.2NA,故A错误;
B、物质的量=$\frac{m}{M}$=$\frac{16g}{16g/mol}$=1mol,甲烷分子中含有4个原子,所以1mol甲烷所含原子数为4NA,故B错误;
C、物质的量=$\frac{m}{M}$=$\frac{17g}{17g/mol}$=1mol,氨气分子中含中子数为7,则17gNH3所含中子数目为7 NA,故C错误;
C、物质的量=$\frac{m}{M}$=$\frac{20g}{20g/mol}$=1mol,D2O中含有质子数为10NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体物质的量和微粒数的计算分析,掌握基础是关键,题目较简单.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na<Mg<Al | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 科学家 | 国籍 | 主要贡献 | |
| A | 贝采利乌斯 | 瑞典 | 首先提出“有机化学”和“有机化合物”的概念 |
| B | 维勒 | 德国 | 首次人工合成了有机物--尿素 |
| C | 李比希 | 法国 | 创立了有机物的定量分析方法 |
| D | 门捷列夫 | 俄国 | 发现元素周期律 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和乙苯 | B. | 乙烯和丁烯 | C. | 甲烷和丙烯 | D. | 乙炔和丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
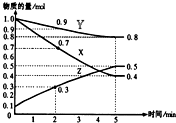 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定体积和浓度的醋酸和氢氧化钠的混合液中一定存在:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) | |
| B. | 常温下pH=10的NaOH和NH3•H2O,加水稀释至pH=9,NaOH加水多 | |
| C. | 难溶电解质CaF2饱和溶液中,c(Ca2+)=amol/L,c(F-)=bmol/L,则Ksp=4ab | |
| D. | 0.1mol/L的碳酸钠溶液中,阴离子浓度大小顺序为:c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com