
下列离子方程式正确的是

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
下图为某药物合成路线的一部分。
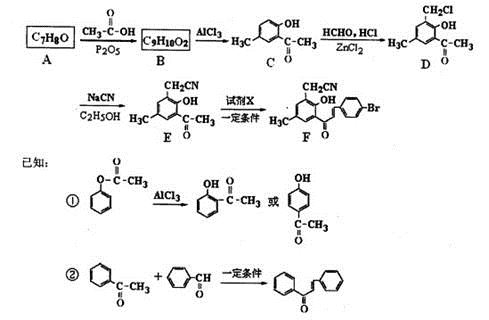
(1)A→B的化学方程式为 ,E中的含氧官能团名称为 、 。
(2)若②的反应历程经历了中间产物 ,则该反应历程先后经历的反应类型为 、 。试剂X的结构简式为 。
,则该反应历程先后经历的反应类型为 、 。试剂X的结构简式为 。
(3)写出两种满足下列要求的D的同分异构体的结构简式 , 。
①分子中有4种化学环境不同的氢原子;
②可发生水解反应,一种产物可发生银镜反应,另一种能与FeCl3发生显色反应;
③分子中的氯原子不与苯环直接相连。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是
A.从海水中提取溴时,不涉及氧化还原反应
B.苯与溴水反应生成溴苯
C.可以用CCl4萃取溴水中的溴
D.向FeBr2溶液中通入Cl2时,一定会发生如下反应:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+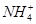 +
+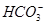 =BaCO3↓+NH3·H2O+H2O
=BaCO3↓+NH3·H2O+H2O
B.氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
C.向亚硫酸钠溶液中加入足量硝酸: +2H+=SO2↑+H2O
+2H+=SO2↑+H2O
D.向AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH↓+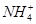
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
下列离子方程式书写正确的是
A.氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
B.碳酸钠溶液中逐滴加入等物质的量的盐酸: +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O=HClO+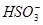
D.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++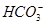 +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式正误判断(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.硫酸铝溶液中加入过量氨水 Al3++3OH-= Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-= CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-= ClO-+Cl-+H2O
D.稀硫酸中加入铁粉 2Fe+6H+= 2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子大量共存与推断(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0. 1mol·L-1NaOH 溶液: K+、Na+、SO42- 、CO32-
B.0. 1mol·L-1Na2CO3溶液: K+、Ba2+、NO3- 、Cl-
C.0. 1mol·L-1FeCl3溶液: K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)= 1×1014的溶液: Ca2+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学碳及其化合物主要性质(解析版) 题型:选择题
下列实验事实所得出的相应结论合理的是
实验事实 | 结论 |
A.Cl2的水溶液可以导电 | Cl2是电解质 |
B.将燃着的镁条伸入盛有CO2的集气瓶中继续燃烧 | 还原性:Mg>C |
C.SO2可以使酸性KMnO4溶液褪色 | SO2具有漂白性 |
D.将铁粉放入稀HNO3中充分反应后,滴入KSCN溶液无明显现象 | 稀HNO3不能将Fe氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:填空题
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置:
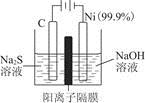
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,
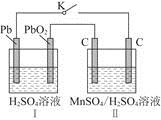
当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的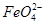 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成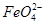
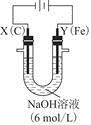
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=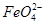 +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com