
【题目】将铜片放入 115mL 某浓度的浓硫酸中,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到 2.24L(标准状况下)氢气。过滤残留固体,干燥后称量,质量减轻了 7.5g。求原硫酸的物质的量浓度________________。
【答案】18.3mol/L
【解析】
Cu与硫酸发生反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+H2O,反应后的溶液加水稀释,再(1)加入Zn发生反应:CuSO4+Zn=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,这两个反应都使得固体质量减轻,Zn与稀硫酸反应产生0.1mol的氢气,消耗Zn0.1mol,质量减轻6.5g,固体共减轻7.5g,所以Zn与硫酸铜反应置换出铜又减轻1g,再利用差量法计算CuSO4+Zn=ZnSO4+Cu中消耗Zn的物质的量;该过程中硫酸先与Cu反应,剩余硫酸与Zn反应,结合(1)中计算,根据CuSO4+Zn=ZnSO4+Cu计算硫酸铜物质的量,再根据Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O,反应后的溶液加水稀释,再(1)加入Zn发生反应:CuSO4+Zn=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,这两个反应都使得固体质量减轻,Zn与稀硫酸反应产生0.1mol的氢气,消耗Zn0.1mol,质量减轻6.5g,固体共减轻7.5g,所以Zn与硫酸铜反应置换出铜又减轻1g,再利用差量法计算CuSO4+Zn=ZnSO4+Cu中消耗Zn的物质的量;该过程中硫酸先与Cu反应,剩余硫酸与Zn反应,结合(1)中计算,根据CuSO4+Zn=ZnSO4+Cu计算硫酸铜物质的量,再根据Cu+2H2SO4(浓)![]() CuSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑计算硫酸物质的量,进而计算原硫酸溶液的物质的量浓度。
CuSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑计算硫酸物质的量,进而计算原硫酸溶液的物质的量浓度。
n(H2)=![]() =0.1mol,根据Zn+H2SO4=ZnSO4+H2↑可知参加反应的Zn为0.1mol,H2SO4为0.1mol;则反应CuSO4+Zn=ZnSO4+Cu中固体质量减少为7.5g-0.1mol×65g/mol=1g,
=0.1mol,根据Zn+H2SO4=ZnSO4+H2↑可知参加反应的Zn为0.1mol,H2SO4为0.1mol;则反应CuSO4+Zn=ZnSO4+Cu中固体质量减少为7.5g-0.1mol×65g/mol=1g,
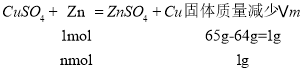
故参加反应的Zn的物质的量为![]() =1mol,CuSO4为1mol;
=1mol,CuSO4为1mol;
由Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O可知反应中消耗硫酸为2mol,因此115ml硫酸溶液中共有H2SO4为2.1mol,则c(H2SO4)=![]() =18.3mol/L。
=18.3mol/L。


科目:高中化学 来源: 题型:
【题目】利用如图所示的装置收集以下7种气体:①H2 ②Cl2 ③O2 ④HCl ⑤NH3 ⑥NO ⑦NO2
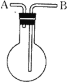
⑴若烧瓶是干燥的,则由B口进气,可收集的气体有___,若把装置颠倒,由A口进气,可收集的气体有____。
⑵若在烧瓶内充满水,可收集的气体有____,气体应由____口进入。
⑶若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有____,气体应由____口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
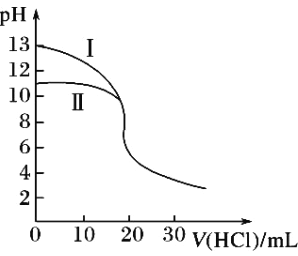
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,在 100 mL 稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在 0~1、1~2、2~3、3~4、4~5 min 各时间段中:反应速率最大的时间段是_______________; 在 0~5min 内,反应速率变化的原因是______________________________________________________________________________________
(2)在 2~3 min 时间段内,用盐酸的浓度变化表示的反应速率为_______________
(3)为了减缓反应速率但不减少产生气的量,在盐酸中分别加入等体积的下列液体:
A.蒸馏水 B.Na2SO4 溶液 C.NaOH 溶液 D.H2SO4 溶液 E.Na2CO3
你认为可行的是(填编号)_______________。
(4)为了加快锌和盐酸的反应,采用了如图的装置。

此装置中负极为_______________,写出正极的电极反应式______________;
若收集到标况下 2.24L 气体,转移了电子_______________________mol,溶解了Zn______________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某包黑色固体混合物可能含有铁粉、氧化铜、炭粉中的二种或三种,取 86.4g 此固体混合物通足量氢气并加热使之反应完全,剩余固体质量 73.6g ,将此剩余固体溶于 1000mL0.500mol·L-1 硫酸中,过滤,向滤液中加入 500mL 某浓度 NaOH 溶液,恰好使沉淀完全,将沉淀灼烧得固体 32.0g。试计算:
(1)所用 NaOH 溶液的浓度是____________mol·L-1。
(2)固体混合物的成分及其物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用元素符号或化学式完成各小题。
IA | ⅡА | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ||||
4 | ② | ④ | ⑩ |
(1)化学性质最不活泼的元素__________________,非金属性最强的元素是___________________。最稳定的气态氢化物是___________________;最高价氧化物对应水化物酸性最强的是_____________________________________________。
(2)金属性最强的单质与水反应的离子方程式为______________。
(3)③⑦⑧⑨四种元素的简单离子半径由大到小的顺序为_________________。
(4)分别写出⑥、⑦和氢形成的气态氢化物的结构式___________________。
(5)用电子式表示②的氧化物的形成过程____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各化合物中,属于同系物的是_____,属于同分异构体的是____。
A.CH3CH2CH2CHO 与 ![]() B.
B.![]() 与
与 ![]()
C.![]() 与
与 ![]() D.
D.![]() 与
与 ![]()
E.![]() 与
与![]() F.戊烯与环戊烷
F.戊烯与环戊烷
(2) 用系统命名法命名下列物质:
①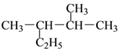 __________________; ②
__________________; ②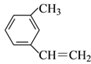 ________________;
________________;
③(CH3)2C=CHCH=CH2 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确且存在因果关系的是
选项 | 实验操作和现象 | 实验结论 |
A | 常温下,取浓度均为0.2mol/L的Na2CO3和NaHCO3溶液各2mL于试管中,分别滴加几滴酚酞试液,后者红色更深。 | 相同温度下,CO32-结合H+能力更强 |
B | 向Na2CrO4溶液中滴加浓硫酸,溶液由橙色变成黄色。 | 增大反应物浓度 平衡正向移动 |
C | 向硅酸钠溶液中通入CO2气体,溶液变浑浊 | 酸性:H2CO3>H2SiO3 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为![]() 、
、![]() 、
、![]() ,下列说法错误的是
,下列说法错误的是
A.Na3A的第一级水解平衡常数Kh1的数量级为10-2
B.在NaH2A溶液中:![]()
C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者
D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com