
| A.明矾对酸性废水中的悬浮颗粒净化作用较弱 |
| B.用焰色反应检验明矾中的钾离子需用到蓝色钴玻璃 |
| C.向明矾的水溶液中滴加Ba(OH)2溶液,当硫酸根沉淀完全时,所得沉淀的质量最大 |
| D.向明矾的水溶液中滴加Ba(OH)2溶液,开始所得沉淀有两种且两种沉淀物质的量相同 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼 |
| B.明矾(KAl (SO4) 2·12H2O)可用于净水 |
| C.二者对应的氧化物均为碱性氧化物 |
| D.Fe3O4是一种红棕色粉末,俗称磁性氧化铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
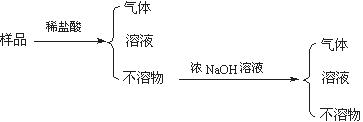
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
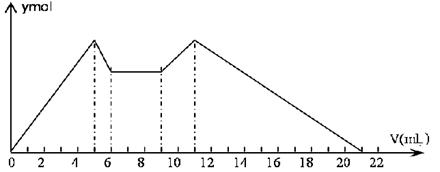
| A.从9到11mL,发生的反应:AlO2-+H++H2O=Al(OH)3↓ |
| B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶2∶5 |
| C.A是NaOH,B是盐酸,且c(NaOH)∶c(HCl)=2∶1 |
| D.从7到9mL,相应离子反应式为:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
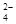 全部转化成BaSO4沉淀,此时铝元素的存在形式是
全部转化成BaSO4沉淀,此时铝元素的存在形式是A.Al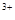 | B.Al(OH)3 | C.AlO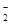 | D.Al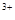 和Al(OH)3 和Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.4:3 | C.3:4 | D.8:9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3∶2 | B.2∶3 | C.3∶4 | D.4∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
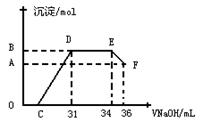
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com