
| A. | 干冰和碘分别变为气体 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 二氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键.
解答 解:A.碘、干冰都是分子晶体,升华变为气体均克服分子间作用力,故A正确;
B.干冰是分子晶体,变为气体时克服分子间作用力,氯化铵是离子晶体,克服离子键,故B错误;
C.二氧化硅是原子晶体,铁是金属晶体,克服作用力分别为共价键、金属键,故C错误;
D.食盐是离子晶体,葡萄糖是分子晶体,克服作用力分别为离子键、分子间作用力,故D错误;
故选A.
点评 本题考查晶体类型与化学键,注意此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力,题目难度不大.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 光导纤维广泛应用于现代通讯,制造光导纤维的主要原料是Si | |
| B. | 二氧化碳不宜用于扑灭金属钠燃烧引起的火灾 | |
| C. | 一定条件下,可将石墨转化为金刚石,这一变化是物理变化 | |
| D. | 氢气作为新型燃料,其突出的优点是氢气轻,便于携带 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 1L0.1mol•L-1的氨水中含有0.1NA个NH4+ | |
| C. | 1molNa被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温常压下,8gO2含有4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
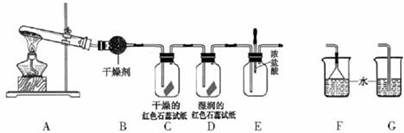
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | |
| Z | W |
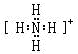 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com