
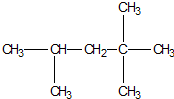
 作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )
作为汽车动力燃料的汽油,其主要成份是异辛烷,其结构简式如图下列各式可以肯定与上述异辛烷互称为同系物的是( )| A. | C2H4 | B. | C8H18 | C. | C7H16 | D. | C6H12 |
科目:高中化学 来源:2017届河南省南阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
A~G各物质间的关系如下图所示,其中B、D为气体单质。则下列说法错误的是
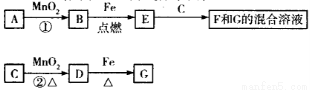
A.已知C的浓溶液在催化剂存在的条件下加热,能与B反应生成D,由此可以推断B的氧化性比MnO2强
B.反应②的离子方程式为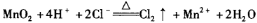
C.新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+,后者可抑制Fe2+的水解
D.若反应①在常温下进行,则1molA在反应中能转移1mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:选择题
常温下,下列溶液中各离子浓度关系表述正确的是
A.向NH4HSO4溶液中逐滴加入NaOH溶液至中性,溶液中
c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
B.等物质的量浓度的Na2CO3,NaHCO3混合溶液中
c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中
c(Na+)-c(F-)<c(K+)-c(CH3COO-)
D.在0.1mol/L的Na2S溶液中
c(H+)+c(HS-)+c(H2S)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:选择题
25℃CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5mol/L,则CaCO3在该温度下的Ksp为
A.9.3×10-5mol/L
B.9.7×10-9mol2/L2
C.7.6×10-17mol4/L4
D.8.7×10-9mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 20 | 40 | 60 | 80 |
| N(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 3.36 L | C. | 4.48 L | D. | 6.72 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
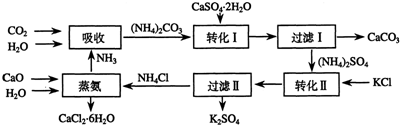
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com