
| A. | CaO+H2O═Ca(OH)2 | B. | 2NH4HCO3$\stackrel{△}{→}$2NH3↑+H2O+CO2↑ | ||
| C. | 4HCl+O2$\stackrel{△}{→}$2H2O+2Cl2 | D. | NaHCO3+NaHSO4═Na2SO4+CO2↑+H2O |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 128gC60中含有90NA个分子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1 mol•L-1CaCl2溶液中Cl-的物质的量浓度为0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 | |
| B. | 物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 | |
| C. | 常温下,某溶液中由水电离出的c(H+)=10-5mol•L-1,则此溶液可能是盐酸 | |
| D. | 常温下,1 mol•L-1的CH3COOH溶液与1 mol•L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体中分散质粒子直径大小在1~100 nm之间 | |
| B. | 可以利用丁达尔效应区分胶体和溶液 | |
| C. | 可利用过滤的方法分离胶体和溶液 | |
| D. | 胶体在一定条件下可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
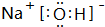 ,其中存在的化学键类型为离子键、共价键.
,其中存在的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Al3+、F-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ne | D. | Mg2+、Na+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料中不含任何化学物质 | |
| B. | 没有水就没有生命 | |
| C. | 这种口服液含丰富的氮、磷、锌等微量元素 | |
| D. | 这种蒸馏水绝对纯净,其中不含任何离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com