
| A. | 湿法炼铜和火法炼铜的反应中,铜元素都发生还原反应 | |
| B. | 加强热,使CuO在高温条件下分解制备单质Cu | |
| C. | 黑色金属材料包括铁、铬、锰及其化合物 | |
| D. | 生铁与钢的区别在于生铁含碳杂质,而钢不含 |
分析 A.铜元素化合价由+2价变为0价,得电子的元素发生还原反应;
B.制备单质Cu用热还原法制备;
C.根据金属的颜色和性质等特征,将金属分为黑色金属和有色金属,黑色金属主要指铁、锰、铬及其合金;
D.生铁与钢的区别为含碳量不同;
解答 解:A.湿法炼铜和火法炼铜的反应中,铜元素化合价由+2价变为0价,所以Cu元素被还原,发生还原反应,故A正确;
B.制备单质Cu用热还原法制备,不是加热法,故B错误;
C.根据金属的颜色和性质等特征,将金属分为黑色金属和有色金属,黑色金属主要指铁、锰、铬及其合金,不是化合物,故C错误;
D.生铁与钢的区别为含碳量不同,均含C元素,但钢中含碳量较低,故D错误;
故选A.
点评 本题考查金属的冶炼、物质的分类,氧化还原概念等知识,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
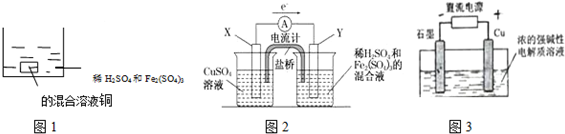
| A. | 如图1 所示将一定量的铜片加入到100 mL 稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L | |
| B. | 如图2 所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X 极是负极,Y 极的材料名称可以是铜 | |
| C. | Cu2O 是一种半导体材料,基于绿色化学理念设计的制取.Cu2O 的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 | |
| D. | 如图3 所示当有0.1mol 电子转移时,有0.1molCu2O 生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,反应每生成2mol H+时电子转移的物质的量为2mol | |
| B. | 放电过程中,正极附近溶液的酸性减弱 | |
| C. | 放电时,正极反应为VO2++2H++e-=VO2++H2O | |
| D. | 充电时,阳极附近溶液由蓝色逐渐变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 6mol•L-1硝酸10mL | 60 |
| B | Mg,0.1 | 3mol•L-1盐酸10mL | 60 |
| C | Fe,0.1 | 3mol•L-1盐酸100mL | 60 |
| D | Mg,0.1 | 3mol•L-1硫酸5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
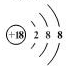 .
.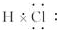 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 实验现象 | 解释原因 |
 | 滴加硝酸银溶液,现象有:产生白色沉淀 | 原因有:氯气与水反应后,电离出Cl-,Cl-与Ag+生成AgCl白色沉淀 |
 | 滴加紫色石蕊试液,现象有:先变红,后褪色 | 原因有:氯气与水反应后,溶液显酸性使紫色石蕊试液变红,产生的HClO又使红色的石蕊试液发生漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
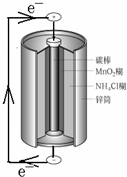
| A. | 锌筒作负极,发生氧化反应 | |
| B. | 电子从锌流向碳棒,碳棒得电子被还原 | |
| C. | 电池内部的NH4+向碳棒移动 | |
| D. | 将NH4Cl更换为KOH能提高电池寿命和性能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验探究离子之间是否发生了反应.
实验探究离子之间是否发生了反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com