
| A. | Fe3+、Cl-、Na+ | B. | Ba2+、Mg2+、CO32- | C. | Na+、K+、CO32- | D. | NO3-、Al3+、OH- |
科目:高中化学 来源: 题型:解答题
 用以下几种常见有机物填写下列空白:
用以下几种常见有机物填写下列空白:| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 104.7g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 318.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
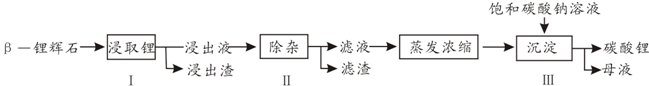
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子中既含有极性键又含有非极性键 | |
| B. | 4.3g HNCO中含有0.1NA个原子 | |
| C. | 反应中NOx是还原剂 | |
| D. | 若NOx中x=2,1mol NO2在反应中转移4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na参加氧化还原反应时电子转移NA | |
| B. | 3.2g SO2与2.3g NO2所含有的氧原子数相等 | |
| C. | 标准状况下,2.24L H2O含有的O原子数为0.1NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应(1)中SO2氧化性比HI强 | |
| B. | 循环过程中不需要补充H2O | |
| C. | 循环过程H2O作催化剂 | |
| D. | 循环过程中产生1mol H2的同时产生0.5mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对的电子总数等于未成对的电子总数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.
A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对的电子总数等于未成对的电子总数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 由图可知该温度下醋酸的电离常数为1×10-4.75 | |
| C. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | 向1L W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):2c(H+)+c(CH3COOH)═c(CH3COO-)+2c(OH-)+2 c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com