
| A. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 | |
| B. | 等质量的乙烷、乙烯、苯充分燃烧,消耗氧气的量由少到多 | |
| C. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
分析 A.根据高分子化合物的定义判断;
B.有机物中含氢越多,燃烧时,消耗氧气的量越大;
C.乙烯含有碳碳双键,可发生氧化、加成反应;
D.乙醇溶于水,乙酸能和碳酸钠反应生成气体,乙酸乙酯不溶于饱和碳酸钠溶液.
解答 解:A.高分子化合物的相对分子质量在10000以上,油脂不是高分子化合物,故A错误;
B.有机物中含氢越多,燃烧时,消耗氧气的量越大,故B错误;
C.乙烯具有还原性,能与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,乙烯中含有双键,能与溴发生加成反应而使溴水褪色,二者原理不相同,故C错误;
D.乙醇溶于水,乙酸能和碳酸钠反应生成气体,乙酸乙酯不溶于饱和碳酸钠溶液,故乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别,故D正确.
故选D.
点评 本题考查常见有机物的性质,为高频考点,题目难度不大,做题时注意把握常见有机物的性质,本题注意有机物耗氧量的计算的角度.


科目:高中化学 来源: 题型:选择题
| A. | 17 g甲基(-14CH3)所含电子数为10NA | |
| B. | 标准状况下,0.56L丙烷中含有共价键的数目为0.2NA | |
| C. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为5NA | |
| D. | 0.1mol9038Sr原子中含中子数为3.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都能设计成原电池 | |
| B. | 原电池两极均发生还原反应 | |
| C. | 原电池中的阳离子向负极移动 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol D2O所含质子数为12 NA | |
| B. | 1 mol C16H34中的极性键数为34 NA | |
| C. | 10 g 氖气所含原子数为NA | |
| D. | 22.4 L正戊烷含氢原子数为12 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
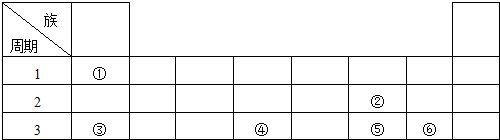
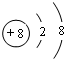 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.4mol•L-1CH3COOH溶液与0.2mol•L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
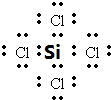
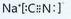 .
.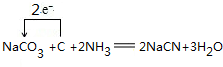 .
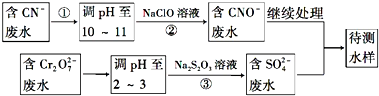
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 | |
| B. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 | |
| C. | 含1mol硫酸的稀溶液与含1molBa(OH)2的稀溶液完全中和所放出的热量为中和热 | |
| D. | 在25℃、101KPa时,2mol 氢气的燃烧热是1mol 氢气的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com