

 .
. 或
或 .
. 原料制备
原料制备
分析 (1)根据A的结构可知A中的含氧官能团;
(2)比较E和F的结构简式可知,E中两个醚键被氢原子取代后生成两个羟基;
(3)A→B中将两个羟基生成两醚键,E→F中又生成两个羟基,主要防止在C到D的转化中酚羟基被氧化;
(4)已知C→D的反应为醇的催化氧化,根据原子守恒可写出此反应的化学方程式;
(5)A的同分异构体具备的条件是:Ⅰ.不能发生银镜反应,说明不含有醛基;
Ⅱ.不能与FeCl3溶液发生显色反应,说明不含有酚羟基,但水解能与FeCl3溶液发生显色反应,说明含有羧酸苯酯基团;
Ⅲ.分子有中4种不同化学环境的氢,说明结构相对对称;
(6)以苯乙醇为 原料制备
原料制备 ,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物.
,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物.
解答 解:(1)有机物A的结构简式为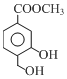 ,含有的官能团为羟基和酯基,故答案为:羟基、酯基;
,含有的官能团为羟基和酯基,故答案为:羟基、酯基;
(2)由E→F的反应类型为取代反应,故答案为:取代;
(3)羟基易被氧化,设计A→B过程可避免C→D过程中被CrO3氧化,故答案为:防止羟基被氧化;
(4)C→D过程中用CrO3作氧化剂发生的反应方程式为 ,故答案为:
,故答案为: ;
;
(5)Ⅰ.不能发生银镜反应,说明不含有醛基;Ⅱ.不能与FeCl3溶液发生显色反应,说明不含有酚羟基,但水解能与FeCl3溶液发生显色反应,说明含有羧酸苯酯基团;Ⅲ.分子有中4种不同化学环境的氢,说明结构相对对称;同时满足上述条件的A的同分异构体有 或
或 ,故答案为:
,故答案为: 或
或 ;
;
(6)以苯乙醇为 原料制备
原料制备 ,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物,具体流程为:
,可以将苯乙醇先氧化得到苯乙醛,再用苯乙醛发生信息反应与NaCN、NH3发生加成反应,加成产物再酸性下水解,最后分子间形成脱水形成肽键即可得到目标产物,具体流程为: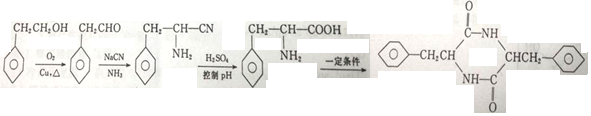 ;故答案为:
;故答案为: .
.
点评 考查有机推断与合成,是高频考点,综合性强,难度大,要求学生要扎实的基础,难点是按要求设计合成路线,灵活利用题中信息是解题关键.


科目:高中化学 来源: 题型:解答题
 金属钒(V)广泛应用于航空、化工、能源等行业.
金属钒(V)广泛应用于航空、化工、能源等行业.| X | X | Y | Y | |
| 试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置A的作用是除去氯气中的水蒸气 | |
| B. | 该实验必须在通风橱中进行 | |
| C. | 装置C中发生的反应为Cl2+2NaOH═NaCl+NaClO+H2O | |
| D. | 装置B的现象是干燥处布条褪色,湿润处布条不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  |  |
| 有效成分 | NaCl | Na2CO3 | Al(OH)3 | NaClO |
| 用途 | 调味品 | 发酵粉 | 抗酸药 | 消毒剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | 乙醇 (乙酸) | CaO | 蒸馏 |
| B | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | CH3CH2Br(Br2) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在一定条件下与水反应 | |
| B. | 在光照条件下,甲烷与氯气的反应 | |
| C. | 在一定条件下,苯与氯气的反应 | |
| D. | 乙烯通入溴的四氯化碳溶液中的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 碳酸氢钠溶液加入少量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 铜与稀硝酸反应制取一氧化氮:Cu+4H++2NO3-=Cu2++2NO↑+2H2O | |
| D. | 在硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 预期的实验现象 | |
| 甲同学的方案 | ||
| 乙同学的方案 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com