
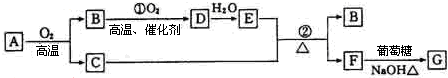
分析 F与葡萄糖/NaOH在加热条件下反应生成G为砖红色沉淀,则G为Cu2O,F为铜盐,A为某金属矿物的主要成分,与氧气反应得到C与B,B氧化得到D,D与水反应得到E,单质C可与E的浓溶液发生反应得到B与F,则A为Cu2S、B为SO2、C为Cu,D为SO3、E为H2SO4,F为CuSO4,据此解答.
解答 解:F与葡萄糖/NaOH在加热条件下反应生成G为砖红色沉淀,则G为Cu2O,F为铜盐,A为某金属矿物的主要成分,与氧气反应得到C与B,B氧化得到D,D与水反应得到E,单质C可与E的浓溶液发生反应得到B与F,则A为Cu2S、B为SO2、C为Cu,D为SO3、E为H2SO4,F为CuSO4.
(1)由上述分析可知,B为SO2,G为Cu2O,故答案为:SO2;Cu2O;
(2)C与硫磺在加热条件下的生成物为Cu2S,Cu2S与足量浓硝酸反应的离子方程式为:Cu2S+12H++10NO3-═2Cu2++SO42-+10NO2↑+2H2O,
故答案为:Cu2S+12H++10NO3-═2Cu2++SO42-+10NO2↑+2H2O;
(3)反应②的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)将0.23molSO2和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molSO3,则:
2SO2(g)+O2 (g)$?_{△}^{催化剂}$2SO3(g)
起始(mol/L):0.23 0.11 0
转化(mol/L):0.12 0.06 0.12
平衡2(mol/L):0.11 0.05 0.12
则反应的平衡常数K=$\frac{(0.12mol/L)^{2}}{(0.11mol/L)^{2}×0.05mol/L}$=23.8 mol-1•L,
第一次平衡时SO3的体积分数为:$\frac{0.12}{0.11+0.05+0.12}$=0.429,
可逆反应中任意物质的浓度不可能为零的特点,设又减小的氧气浓度为xmol/L,可得关系式:$\left\{\begin{array}{l}{0.11-2x>0}\\{0.55-x>0}\end{array}\right.$,解得x<0.055,所以第二次平衡时SO3的体积分数最大为:$\frac{0.12+0.055×2}{0.12-0.055×2+0.55-0.055+0.12+0.055×2}$=0.313,SO3体积分数减小了,
故答案为:23.8 mol-1•L;减小.
点评 本题考查无机物推断,“F与葡萄糖/NaOH反应生成砖红色沉淀”是推断突破口,需要学生熟练掌握元素化合物知识及中学常见化学工业,(4)中三氧化硫含量比较为易错点,注意利用极限法解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁跟硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 碳酸钙跟醋酸反应CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 在碳酸氢钙溶液中加入盐酸CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 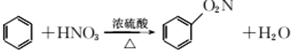 | |
| B. | CH2═CH2+Br2-→CH3CHBr2 | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 家庭中不宜用铝合金容器长期存放咸的食品 | |
| C. | 水处理常用到明矾和漂白粉,但二者的作用原理不同 | |
| D. | 黄河入海口沙洲的形成体现了胶体聚沉的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| B. | 金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaO+H2O═Ca(OH)2能放出大量的热,故可通过原电池实现该反应,并把化学能转化为电能 | |
| B. | 在原电池或电解池装置中,都可实现反应:Cu+2H+═Cu2++H2 | |
| C. | 若原电池的两极是活泼性不同的两种金属,则活泼的金属不一定做负极 | |
| D. | 在钢铁制品上镶嵌锌块构成原电池以防治钢铁生锈,这种防护方法叫外加电源阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A. | 0→c段,发生反应的离子方程式为:Al3++4OH-═[Al(OH)4]- | |
| B. | a-b段,溶液pH增大,Al3+浓度不变 | |
| C. | b-c段,加入的OH-主要用于生成Al(OH)3沉淀 | |
| D. | d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com