
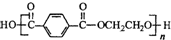
 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )| A. | 羊毛的主要成分属于蛋白质 | |
| B. | 涤纶属于天然高分子化合物 | |
| C. | 合成涤纶的单体之一可以是HOCH2CH2OH | |
| D. | 可用灼烧的方法区别羊毛和涤纶 |
科目:高中化学 来源: 题型:解答题
 2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.
2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物是离子化合物,且最外层电子均满足8电子结构的 | |
| B. | 工业上通常采用电解Y的熔融氧化物的方法制得Y | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X和Z的最高价氧化物对应的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定存在Na+、I-、CO32- | |
| B. | 溶液中一定不存在的只有I-、SO32- | |
| C. | 只需再进行一个实验,就可完全确定溶液的组成 | |
| D. | 溶液中一定存在Br-、CO32-,至少存在Na+、NH4+中的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中滴加足量氨水 | |
| B. | 向酚酞试液中通入过量Cl2 | |
| C. | 向紫色石蕊试液中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
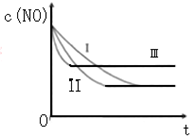 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com