
 ;ZX2的化学式是SiO2.
;ZX2的化学式是SiO2. 分析 化合物YX2、ZX2中X、Y、Z都是前三周期元素,X原子最外能层的p能级中有一个轨道填充了2个电子,则X的最外层电子排布式为ns2np4,为第VIA族元素;
Y原子的最外层中p能级的电子数等于前一能层电子总数,p能级最多排列6个电子,则Y次外层为K层,Y原子最外层p能级上电子数是2,Y原子含有6个电子,为C元素,X与Y同周期,Y与Z同主族,所以X是O元素,Z为Si元素,据此分析.
解答 解:化合物YX2、ZX2中X、Y、Z都是前三周期元素,X原子最外能层的p能级中有一个轨道填充了2个电子,则X的最外层电子排布式为ns2np4,为第VIA族元素;
Y原子的最外层中p能级的电子数等于前一能层电子总数,p能级最多排列6个电子,则Y次外层为K层,Y原子最外层p能级上电子数是2,Y原子含有6个电子,为C元素,XX与Y同周期,Y与Z同主族,所以X是O元素,Z为Si元素,
X是O元素,原子序数为8,其最外层有6个电子,所以O的电子排布式为1s22s22p4,Y是C原子,根据构造原理知,其核外电子排布式为:1s22s22p2,其简化电子排布式为[He]2s22p2;Z为Si元素,最外层有4个电子,则其价电子排布式为3s23p2;YX2的化学式是CO2,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ;ZX2的化学式是SiO2;
;ZX2的化学式是SiO2;
故答案为:1s22s22p2;[He]2s22p2;3s23p2;CO2; SiO2.
SiO2.
点评 本题考查位置、结构、性质的关系及应用,把握原子中电子排布及分子结构为解答的关键,侧重分析、推断能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| B. | Fe $→_{点燃}^{Cl_{2}}$ FeCl2$\stackrel{NaOH溶液}{→}$ Fe(OH)2 | |
| C. | AlCl3(溶液)$\stackrel{蒸发}{→}$ AlCl3$\stackrel{电解}{→}$ Al | |
| D. | NaCl(饱和溶液)$\stackrel{依次通入NH_{3}、CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;分子N中含有2个手性碳原子.
;分子N中含有2个手性碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子构型为ns2(n≠1),次外层电子数为8 | |
| B. | 外围电子构型为3d104s2 | |
| C. | 外围电子排布式为ns2np4 | |
| D. | 外围电子排布式为(n-1)d5ns2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3s2和3s23p5 | B. | 2s22p2和2s22p4 | C. | 1s1和3s23p4 | D. | 3s23p4和2s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
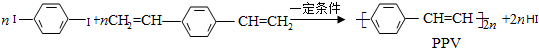
| A. | PPV是聚苯乙炔 | |
| B. | 该反应为缩聚反应 | |
| C. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| D. | 1 mol 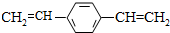 最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com