
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g)  2NH3(g)(正反应为放热反应)。下列说法错误的是( )
2NH3(g)(正反应为放热反应)。下列说法错误的是( )
A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大
B.升高平衡体系的温度(保持体积不变),混合气体的密度不变
C.当反应达到平衡时,N2和H2的浓度比是 1∶3
D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动
科目:高中化学 来源: 题型:
将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用①共价键 ②离子键 ③分子间作用力,正确的顺序是
A.①②②③ B.②①②③ C.②③②① D.①①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.煤中含有苯和甲苯,可用分馏的方法把它们分离出来
B. C7H16的烷烃中,含有3个甲基的同分异构体有2种
C. 碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的
单烯烃有6种
D.某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子
结构中只有一个烷基,符合条件的烃有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是( )
A.强酸性溶液中:K+、Al3+、CH3COO-、SO42-
B.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO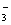 、Br-、Ba2+
、Br-、Ba2+
C.室温下,pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K= 。 0~4min的平均反应速率v(CO)=_____mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时, 容器内各物质的浓度变化如下表。
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
① 表中3min~4min之间反应处于______状态; c 1数值_____0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是
A. 氨气的燃烧热为-316.3kJ·mol-1,则氨气燃烧的热化学方程式可表示为:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -316.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应
NH3(g),放热19.3kJ,其热化学方程式为:
N2 (g) + 3H2(g)  2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C. 由C(石墨)= C(金刚石)△H=+1.90kJ·mol-1 ,可知金刚石比石墨稳定
D. 由H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,可知将含0.5molH2SO4的浓溶液
与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
引起下列物质颜色变化的化学方程式(或离子方程式)表示正确的是 ( )
A.暴露在空气中,淡黄色Na2 O2变成白色固体:Na2O2 +H2O 2Na+ +2OH-+O2 ↑
B.降温至-15℃时,红棕色NO2变成无色液体:2NO2  N2O4
N2O4
C.向AgCl悬浊液中加入硫化钠变黑:2Ag+ +S2- Ag2S↓
D.向CuSO4溶液中加入Ba(OH)2溶液,观察到有色沉淀生成:Cu2+ +2OH- Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
“嫦娥一号”的登月成功,实现了中国人“奔月”的梦想。
⑴ 2H2(g)+O2(g)=2H2O(l); H=-571.6kJ·mol-1
H=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l); H=-5518 kJ·mol-1
H=-5518 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)  H =-890kJ·mol-1
H =-890kJ·mol-1
相同质量的H2 、C、 C8H18 、CH4完全燃烧时,放出热量最多的是 。
⑵ 氢气、氧气不仅燃烧能放出热量,二者形成的原电池还能提供电能。“嫦娥一号”绕月飞行部分使用的是氢氧燃料电池,电解质溶液为KOH溶液,其电极反应式为:
负极 ;正极 ;
⑶若用氢氧燃料电池电解100mL由NaCl 和CuSO4组成的混合溶液,其中
[Na+]=3[Cu2+]=0.3mol·L-1,用石墨作电极,通电一段时间后,在阴极收集到0.112L H2(标况).
试计算:
①阴极析出Cu mol。阳极析出气体为 (填化学式)。
②若所得溶液仍然为100mL,则此时溶液的pH值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com