
1)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有离子交换膜【阴(阳)离子交换膜只允许阴(阳)离子通过】,其工作原理如图所示。

①该电解槽的阳极反应式是 。
②图中a、b两处分别加入的物质是 、 ;离子交换膜为 (填“阴”或“阳”)离子交换膜。
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
(2)海洋资源的开发与利用具有广阔的前景,海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
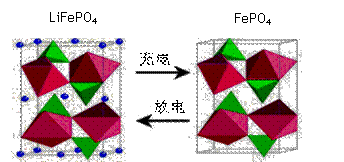
该电池电解质为能传导 Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),电极反应式为 。
(3)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下空气和氯气的体积比为___________________(空气中氧气的体积分数按20%计)。
(4)海水中也含有大量的镁元素,高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如下图,该电池反应的总离子方程式为 。

【考点】本题考查了电解池原理,电极反应式的书写等知识。
【解析】(1)①电解硫酸钾溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=2H2O+O2↑。③电解时,阴极上氢离子放电生成氢气,同时溶液中产生氢氧化钾,气体从上口C放出,则氢氧化钾从B口流出。
(2)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4;
(3)该过程中放生了氧化还原反应,根据氧化还原反应得失电子守恒可知,假设锰酸钾(K2MnO4)的物质的量是1mol,所以制备的过程中会消耗氧气的物质的量为0.5mol,则需要空气2.5mol,1mol锰酸钾(K2MnO4)和氯气反应则消耗氯气的物质的量是0.5mol,所以消耗相同条件下空气和氯气的体积比为5:1;
(4)①根据题意可知,反应物为MgSO4、CO,生成物为MgO+SO2+CO2+SO3,反应条件是750℃,所以发生的花学方程式为①2MgSO4+CO 2MgO+SO2+CO2+SO3。②负极上镁失电子,正极上次氯酸根离子得电子,所以电池反应为Mg+ClO-+H2O=Mg(OH)2↓+Cl-。
2MgO+SO2+CO2+SO3。②负极上镁失电子,正极上次氯酸根离子得电子,所以电池反应为Mg+ClO-+H2O=Mg(OH)2↓+Cl-。
【答案】(16分)
(1)① 4OH- - 4e- = 2H2O + O2↑(1分) ②工业品KOH(1分) H2O(含少量KOH)(1分) 阳(2分)③B(2分)
(2)正(1分) FePO4+e- +Li+=LiFePO4(2分)
(3)5:1(2分)
(4)①2MgSO4+CO 2MgO+SO2+CO2+SO3(2分)②Mg+ClO-+H2O=Cl-+Mg(OH)2(2分)
2MgO+SO2+CO2+SO3(2分)②Mg+ClO-+H2O=Cl-+Mg(OH)2(2分)


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
环保部制定的《环境空气质量标准》第二次公开征求意见结束,大家普遍赞成将PM2.5(PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物)纳入常规空气质量评价,下列有关PM2.5说法不正确的是
A.PM2.5表面积大能吸附大量的有毒、有害物质
B.PM2.5在空气中形成气溶胶
C.实施绿化工程,可以有效地防治PM2.5污染
D.研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反 应方程式:__________________________________________________。
应方程式:__________________________________________________。
 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为________________________________,正极的反应式为________________。理想状态下,该燃料电池消耗1 mol 甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:(1)Na3N的电子式是__________;该化合物是由__________键形成的__________(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是
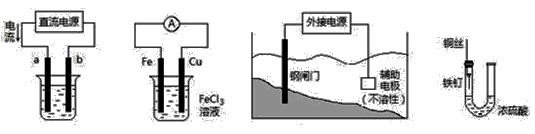
① ② ③ ④
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+= Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是
A.漂白粉长时间露置空气中会结块变质
B.金属钠在空气中燃烧产生黄色火焰,生成淡黄色固体
C.为防船体被腐蚀,远洋货轮船底外壳镶嵌锌块,其中锌发生还原反应
D.两根分别蘸有浓盐酸、浓氨水的玻璃棒靠近有白烟产生
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,10 mL0.1mol·L-1的氨水加水稀释后,下列说法正确的是
A.溶液的pH增大
B.溶液中NH4+和OH—离子的数目减少
C.NH3·H2O的电离程度增大,c(H+)也增大
D.加入适量盐酸使c(NH+4)=c(Cl—),混合液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
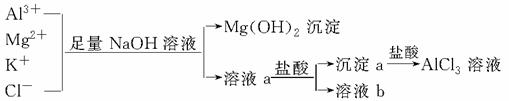
下列说法正确的是
A.NaOH溶液可以用氨水来代替
B.溶液a中含有Al3+、K+、Cl-、Na+、OH-
C.溶液b中只含有NaCl
D.向溶液a中滴加盐酸需控制溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com