
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:阅读理解
| 实验 序号 |
温度℃ | 初始n(CCl4) (mol) |
初始n(H2) (mol) |
平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下:
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4+ H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4+ 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下:
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省海门市高二下学期期末教学质量调研化学试题 题型:填空题
氮是地球上极为丰富的元素。
(1)N2是大气的主要成分之一,由于分子中键能很大,所以性质稳定。已知N≡N的键能为946 kJ·mol-1,N—N单键的键能为193 kJ·mol-1。
计算:N2分子中“π”键的键能约为 ;
结论:N2分子中“σ”和“π”键的稳定性 。
(2)氮的氧化物是大气污染物之一。为了消除污染,科研人员设计了同时消除二氧化硫和氮的氧化物的方法,其工艺流程如下: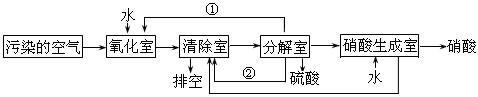
其中清除室、分解室发生的反应如下:
清除室:NO + NO2 = N2O3 N2O3 + 2H2SO4 = 2NOHSO4 + H2O
分解室:4NOHSO4 + O2 + 2H2O = 4H2SO4 + 4NO2
回答下列问题:
Ⅰ.①和②分别为(写化学式) 、 ;
Ⅱ.氧化室发生的反应是 ;
(3)金属氮化物是一类重要的化学物质,有着特殊的用途。某金属离子(M+)与N3—形成的晶体结构如右图所示。其 中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。
中M+中所有电子正好充满K、L、M三个电子层,它M+的符号是 ,与同一个N3-相连的M+有 个。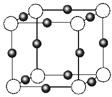
(4)NH3既是重要的工业产品,又是主要的工业原料。以NH3为原料生产硝酸铵的过
程如下: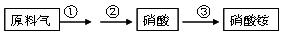
其中反应②为:4NO+3O2+2H2O=4HNO3 原料气为氨气和空气的混合物,假设空气中氧气的体积分数为0.2。
Ⅰ.写出反应①的化学方程式 。若不考虑副反应且各步反应均完全,生产过程中原料气中的氨气(不包含第③步被硝酸吸收的氨气)和空气中氧气恰好全部转化为硝酸,则原料气中制备硝酸的氨气和氧气的体积比为 。
Ⅱ.若实际生产中,反应①中氨的转化率(或利用率)为70%,反应②中NO的转化率为90%,反应③中氨和硝酸均完全转化。则生产硝酸的氨气占所用氨气总量的体积分数为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省协作体高三第一次联考理综化学试卷(解析版) 题型:填空题
2013年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
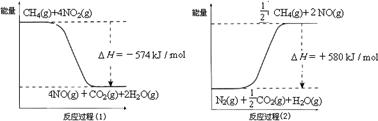
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
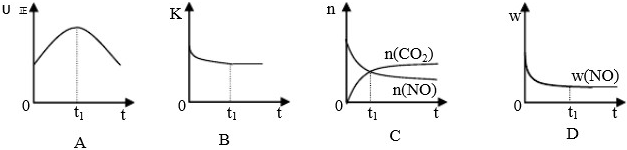
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是???????? (填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)? △H=-867 kJ/mol
2NO2(g) N2O4(g)?? △H=-56.9 kJ/mol
N2O4(g)?? △H=-56.9 kJ/mol
H2O(g) = H2O(l)?? ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:???????????????????????????????????? 。
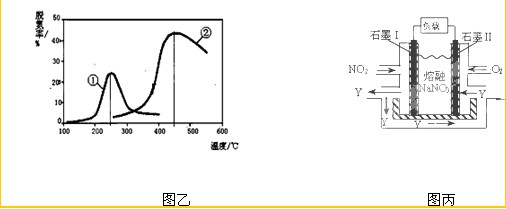
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),
反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。

①该反应的△S???? 0,△H????? 0(填“>”、“=”或 “<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),
则上述反应的KP=???????????????? 。
③以下说法正确的是????????????????? 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为?? ??????????????????? ? 。

(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去。反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为___________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com